Resistenzen bei der
CAR-T-Zell-Therapie auf der Spur
Bei der Behandlung von Myelom-Patienten mit CAR-T-Zellen kann es zu folgenschweren Resistenzen kommen. Ärzte und Wissenschaftler des UKW und des Helmholtz-Instituts für RNA-basierte Infektionsforschung konnten einen der dahinterstehenden Mechanismen aufdecken.
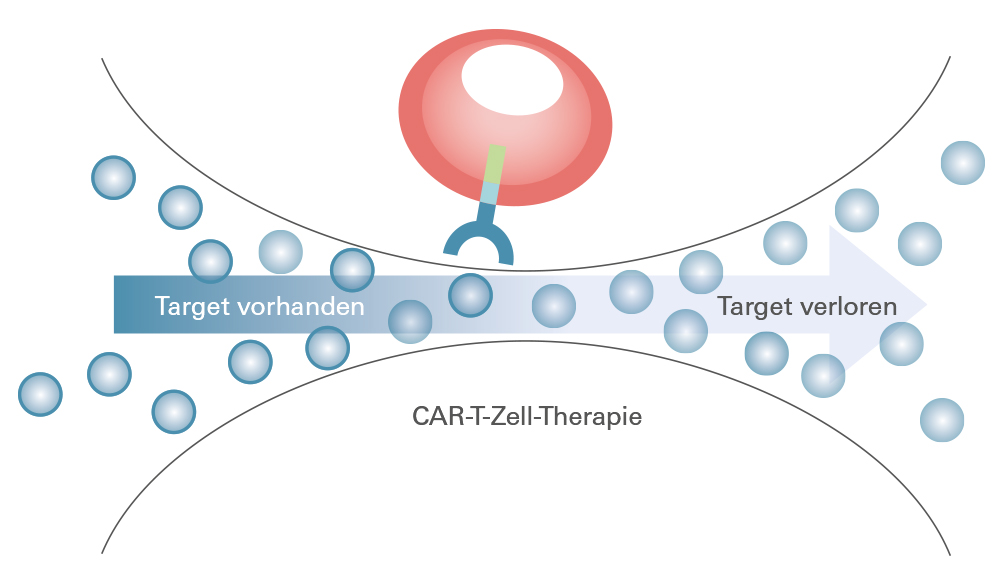
Die Myelom-Zellen mit BCMA-Expression (Target, blauer Ring) werden durch die CAR-T-Zell-Therapie vernichtet, während die zunächst vereinzelten Myelom-Zellen ohne BCMA-Expression (ohne Ring) unangetastet bleiben. Der Selektionsdruck der Therapie gibt diesen im Anschluss die Chance zu massenhafter Vermehrung.
Am UKW wurde unter Leitung von Prof. Dr. Hermann Einsele, dem Direktor der Medizinischen Klinik II (Med II), Ende des Jahres 2018 in einer Studie erstmals ein intensiv vorbehandelter Myelom-Patient mit schlechter Prognose mit CAR-T-Zellen therapiert. Die Behandlung sprach geradezu spektakulär an: Innerhalb kürzester Zeit schien das Knochenmark komplett von Tumorzellen befreit zu sein. Doch nach fünf Monaten kam es zu einem massiven Rückfall: Das Knochenmark war erneut mit Myelom-Zellen geflutet und der Patient verstarb innerhalb weniger Wochen. Das Ziel-Antigen ging verloren Auf der Suche nach den Ursachen dieses folgenschweren Verlaufs deckten Forscher der Med II und des Würzburger Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI) einen Resistenzmechanismus auf, den sie im Februar dieses Jahres in der Fachzeitschrift Nature Medicine veröffentlichten.
Eine Schlüsselrolle spielt BCMA, ein Antigen auf der Oberfläche von Myelom-Zellen. „Wir haben zum Zeitpunkt des Rückfalls die Tumorzellen des Patienten untersucht und mussten feststellen, dass BCMA, die für den Behandlungserfolg entscheidende Zielstruktur, nun vollkommen fehlte“, berichtet Dr. Leo Rasche, Oberarzt der Med II und Initiator der Studie.
Um diesem zunächst unerklärlichen Verlust auf die Spur zu kommen, analysierten Wissenschaftler des HIRI per Einzelzell-Sequenzierung der RNA das Genom tausender der fraglichen Myelom-Zellen. „Es zeigte sich, dass bei den Krebszellen, die während des Rückfalls neu entstanden, derjenige Genabschnitt fehlte, der den Code für das BCMA enthält“, berichtet Dr. Emmanuel Saliba, Leiter der Einzelzellanalyse am HIRI. Dahinter steckt nach Auffassung der Forscher eine durch die CAR-T-Zell-Therapie hervorgerufene Selektion. Dr. Rasche erläutert: „Neben der riesigen Mehrheit der Myelom-Zellen mit BCMA gab es wahrscheinlich schon vor der Behandlung mit CAR-T-Zellen vereinzelt eine genetische Variante ohne BCMA. Während die Zellen mit BCMA erfolgreich aufgespürt und eliminiert wurden, hatten die verbleibenden Zellen ohne BCMA einen so hohen Überlebensvorteil, dass sie sich in der Folge sprunghaft ausbreiten konnten.“ CAR-T-Zell-Therapien nicht nur auf ein Antigen richten Diese Erkenntnis kann sich auf die Gestaltung künftiger CAR-T-Zell-Therapien auswirken. „Vieles spricht dafür, dass man mit CAR-T-Zellen nicht nur gegen ein spezifisches Antigen feuern sollte, sondern vielmehr zwei oder sogar drei Ziele gleichzeitig adressieren muss“, sagt Dr. Rasche. Technisch sei dies durchaus möglich: Man könne einem Patienten zwei CAR-T-Zell-Produkte gleichzeitig geben oder multispezifische CAR-T-Zellen einsetzen, die an ihrer Oberfläche mit mehreren Antigen-Rezeptoren ausgestattet sind. „Dadurch würde man den Selektionsdruck verteilen. Die Wahrscheinlichkeit, dass Tumorzellen überleben, würde so bedeutend kleiner“, unterstreicht der Internist. Und Prof. Einsele ergänzt: „Die Aktivität der CAR-T-Zellen ist beeindruckend. Umso wichtiger ist es, die Resistenzmechanismen noch besser zu verstehen, um diese zukunftsweisende Therapie weiter zu optimieren. Die Einzelzell-RNA-Sequenzierung hat sich dabei als ideales Screeningtool erwiesen.“