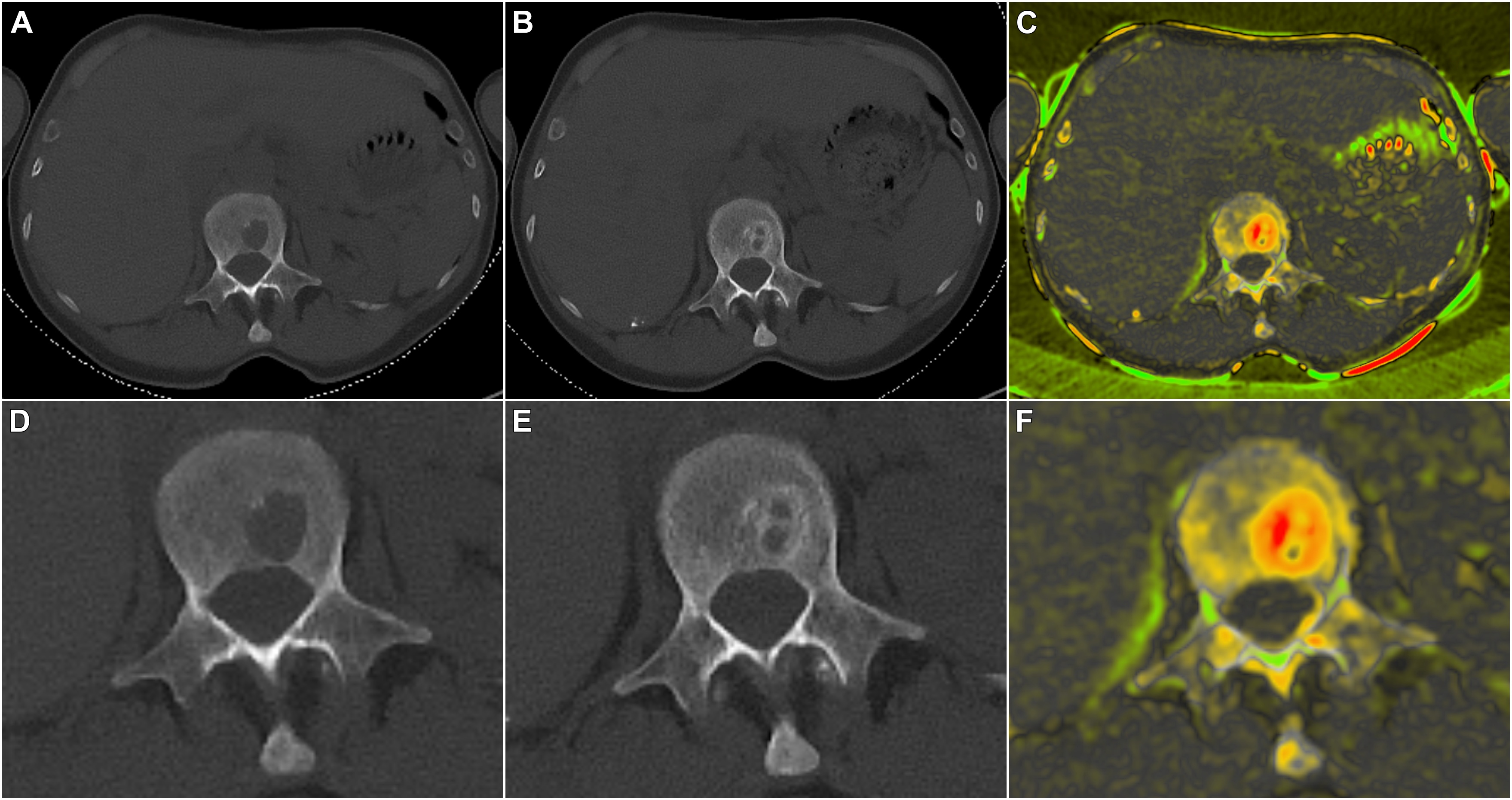
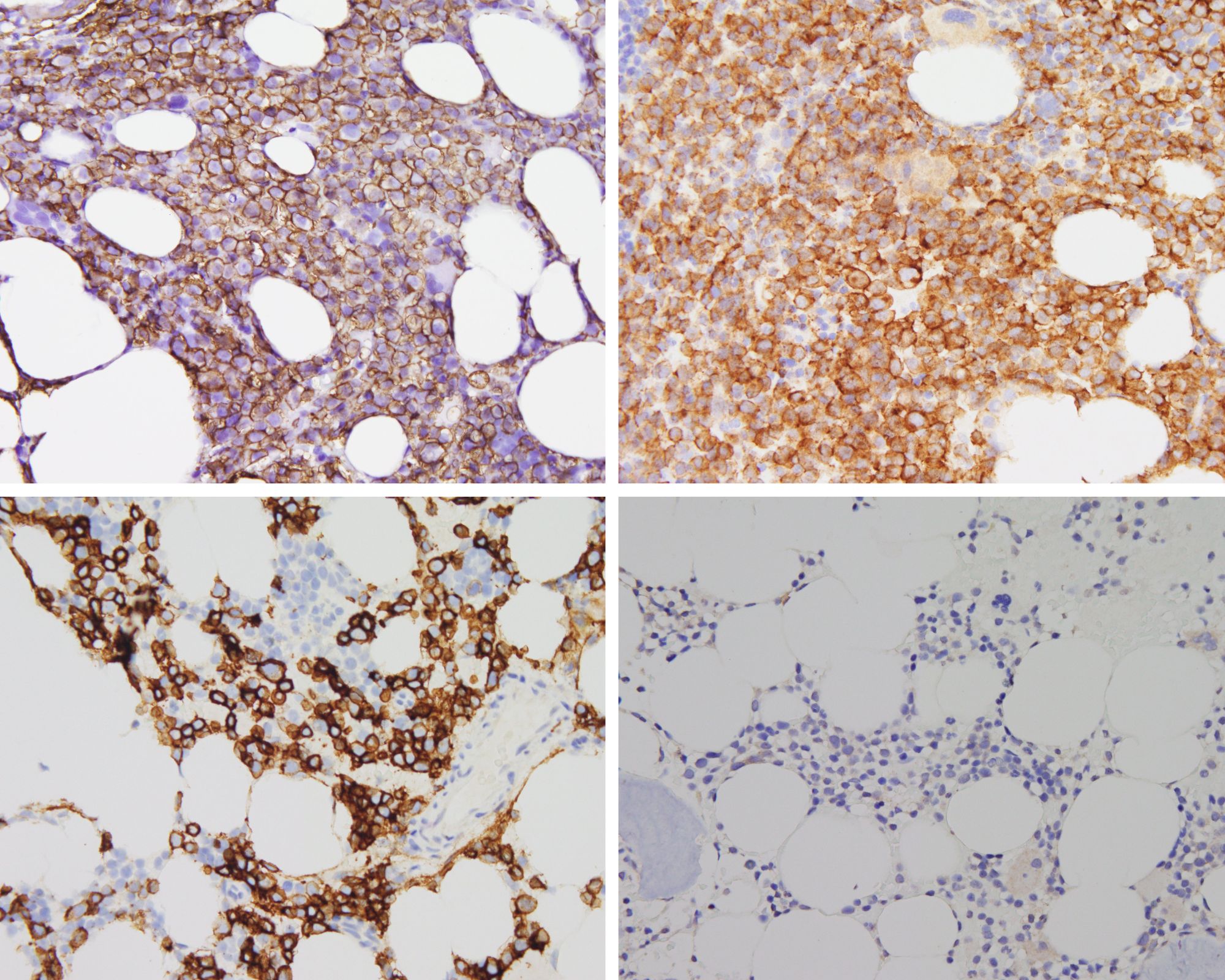
Würzburg. Krebszellen sind von einer dicken Zuckerschicht umgeben, die es ihnen ermöglicht, sich der Erkennung durch Immunzellen zu entziehen und der Zerstörung zu entgehen. „Die Schicht aus Zucker-Molekülen wirkt wie eine Tarnkappe“, erklärt Dr. Andoni Garitano-Trojaola und bringt seinen Forschungsfokus direkt auf den Punkt: „Das Verständnis dieses Mechanismus ist von entscheidender Bedeutung für die Entwicklung gezielter Therapien, welche die schützende Zuckerschicht durchbrechen können. Dadurch könnten die Krebszellen anfälliger für die Überwachung durch das Immunsystem werden, was die Effektivität von Immuntherapien gegen Krebs steigern würde.“ Das Gilead Förderprogramm unterstützt sein Forschungsprojekt am Uniklinikum Würzburg (UKW) mit 53.000 Euro.
Bessere Krebstherapien durch besseres Verständnis der Pathomechanismen
Die Medizinischen Klinik und Poliklinik II hat sich durch starke Kompetenzen in den Bereichen Molekularbiologie und CAR-T-Zelltherapie weltweit einen Namen gemacht hat. Hier befasst sich Andoni Garitano-Trojaola mit seinem Team sowohl mit grundlagenwissenschaftlichen als auch mit translationalen Fragestellungen im Bereich Hämatologie. Übergeordnetes Ziel ist es, die Situation von Patientinnen und Patienten mit Krebserkrankungen, die das blutbildende System betreffen, zu verbessern. „Und dies kann im Wesentlichen nur durch ein besseres Verständnis der zu Grunde liegenden Pathomechanismen gelingen“, sagt Andoni Garitano-Trojaola. Der Biochemiker gilt als international ausgewiesener Experte im Bereich der translationalen Krebsforschung.
Zuckerschicht auf Tumorzellen durchbrechen oder entfernen
In den letzten Jahren konnte die Universitätsmedizin Würzburg bereits wegweisende Mechanismen der Resistenzentwicklung gegenüber Immuntherapien bei hämatologischen Erkrankungen veröffentlichen. Andoni Garitano-Trojaola will nun die genaue Zusammensetzung der Zuckerschicht auf den Krebsantigenen definieren und Behandlungen entwickeln, mit denen diese abnorme Zuckerschicht entfernt oder durchbrochen werden kann. Und schließlich gilt es festzustellen, ob die Entfernung der Zuckerschicht auf den Krebszellen zu einer stärkeren Antitumorreaktion von CAR-T-Zelltherapien führt. Die gewonnenen Erkenntnisse könnten von entscheidender Bedeutung für die Entwicklung wirksamerer CAR-T-Therapien für Krebspatientinnen und -patienten sein.
Biochemiker mit MBA
Andoni Garitano-Trojaola stammt aus dem spanischen Baskenland und hat sein Studium der Biochemie an der Universität von Navarra abgeschlossen. Anschließend absolvierte er einen Master in Biomedizinischer Forschung und promovierte in der Krebsforschung an der Cima Universidad de Navarra. Im Jahr 2016 zog er nach Würzburg, um in der Medizinischen Klinik und Poliklinik II seine Karriere in der Translationalen CAR-T-Zellforschung fortzusetzen. Vor kurzem hat er zudem ein Master of Business Administration-Studium an der Frankfurt School of Finance & Management erfolgreich abgeschlossen.
Weitere Informationen zu Immuntherapien in der Hämatologie:
Als große Hoffnungsträger in Behandlung bösartiger Erkrankungen, die das blutbildende System betreffen, gelten Immuntherapien mit Antikörpern oder Gen-manipulierten T-Zellen, den so genannten CAR-T-Zellen. Die Wahl der Immuntherapie und ihr Erfolg hängt im entscheidenden Maße davon ab, ob, wie viele und welche Antigene sich auf der Krebszelle befinden. Das Universitätsklinikum Würzburg (UKW) spielt bei der Erforschung, Anwendung und Ausweitung dieses neuen Arzneimittelprinzips eine international bedeutende Rolle.
Eine der vielversprechendsten Behandlungsmethoden gegen den Knochenmarkkrebs sind CAR-modifizierte Immunzellen. Bei der zellulären Immuntherapie wird den weißen Blutkörperchen unseres Immunsystems, den T-Zellen, auf die Sprünge geholfen. Dazu werden die T-Zellen gentechnologisch verändert und im Labor mit einem künstlichen auf die entsprechende Krebsart zugeschnittenen Rezeptor ausgestattet, dem Chimären Antigen Rezeptor, kurz CAR. Anschließend werden die „scharf gestellten“ T-Zellen als lebendes Medikament dem Patienten zurückgegeben. Mithilfe des spezifischen Oberflächenmarkers können die CAR-T-Zellen die Tumorzellen im Körper aufspüren und zerstören.