Führend in der Therapieforschung bei Multiplem Myelom
Das Multiple Myelom (MM) ist eine bösartige Krebserkrankung des Knochenmarks. Bei der Erforschung, Anwendung und Ausweitung von diesbezüglichen Therapieoptionen spielt das UKW eine international bedeutende Rolle. Das spiegelte sich im Jahr 2021 unter anderem in mehreren hochrangigen Studienpublikationen wider.
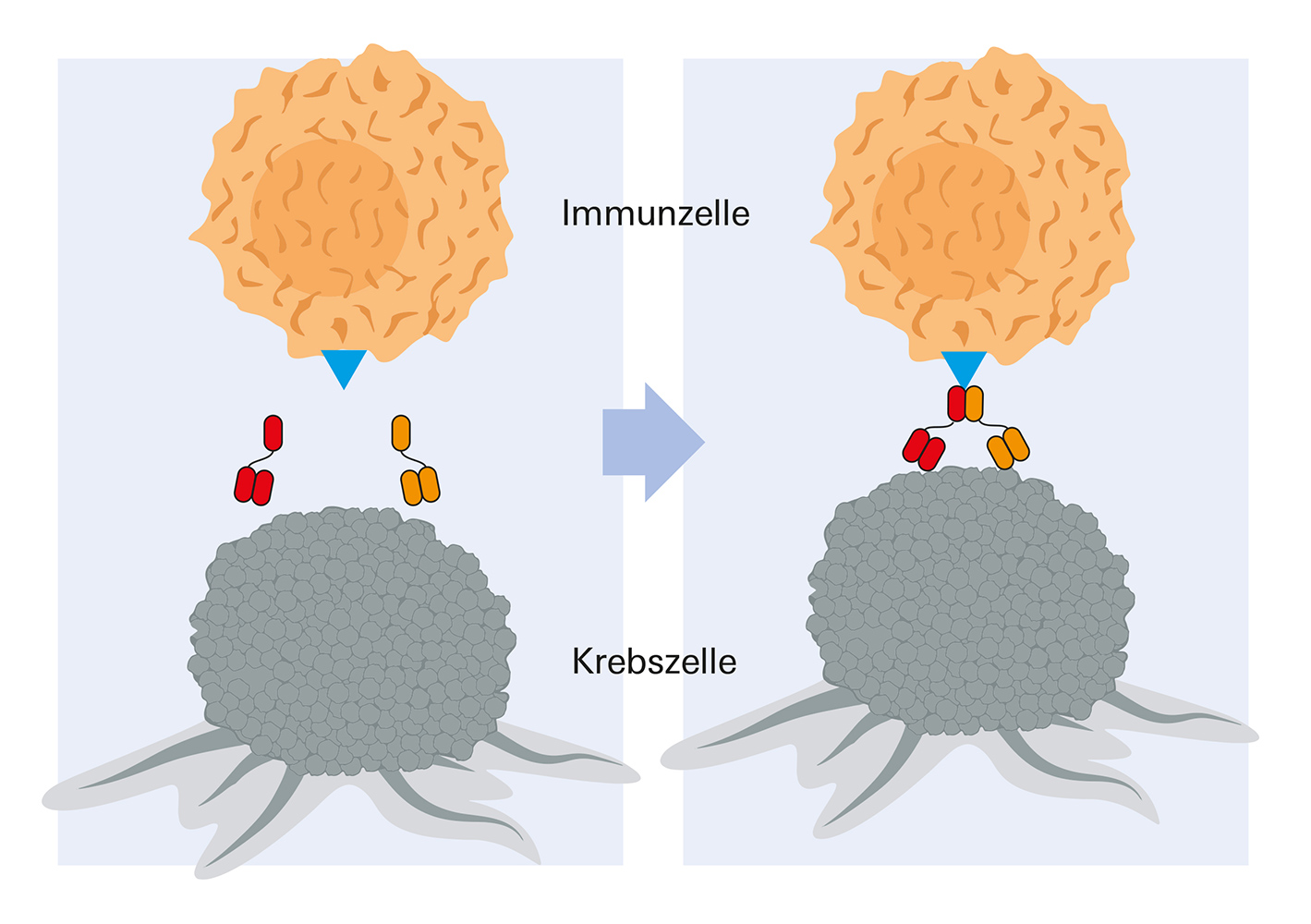
Links: zwei Hemibodies binden sich an die Krebszelle. Rechts: Anschließend fügen sich die beiden Hemibodies zusammen, halten eine Immunzelle (T-Zelle) fest und aktivieren diese.
So erschien im Januar 2021 in der Fachzeitschrift Communications Biology ein Beitrag, in dem Expertinnen und Experten der von Prof. Dr. Hermann Einsele geleiteten Medizinischen Klinik II (Med II) die Funktionsweise von Hemibodies und die mit ihnen beim MM bislang erreichten Erfolge darlegen. Bei der Hemibody Technologie wird für zwei unterschiedliche Zielmoleküle auf der Oberfläche von Myelom-Zellen jeweils ein gentechnisch maßgeschneidertes Antikörper-Fragment injiziert. Sie binden am passenden Ziel-Antigen und finden sich anschließend zu einem Paar mit dann immunstimulierenden Eigenschaften zusammen. Neben dem Beleg der Effizienz beim Kampf gegen die Myelom-Zellen konnten die Würzburger Forscherinnen und Forscher bislang im Reagenzglas und im Tiermodell beweisen, dass bei diesem Verfahren ungewollte Effekte, wie eine massive Zytokinfreisetzung, zuverlässig vermieden werden können.
Hohe Wirksamkeit von Ide-Cel dokumentiert Als ein weit fortgeschrittener Hoffnungsträger bei der Behandlung des MM gilt die Immuntherapie Idecabtagene Vicleucel – oder verkürzt Ide-Cel. Hierbei handelt es sich um eine CAR-T-Zell-Therapie im Teststatus. Gentechnologisch mit einem chimären Antigenrezeptor (CAR) ausgestattete körpereigene T-Zellen zielen auf das B-Zell-Reifungsantigen (BCMA) ab, das auf der Oberfläche von Tumorzellen vorkommt. Eine im Februar 2021 im New England Journal of Medicine veröffentlichte Phase II-Studie dokumentiert die hohe Wirksamkeit von Ide-Cel bei ansonsten austherapierten Patientinnen und Patienten mit rezidiviertem MM. Die Med II war als unter den europäischen Partnern führendes Zentrum maßgeblich an dem internationalen Forschungsvorhaben beteiligt. Die Studienergebnisse trugen erheblich dazu bei, dass Ide-Cel im Sommer 2021 die EU-Zulassung für die genannte Patientengruppe erhielt.
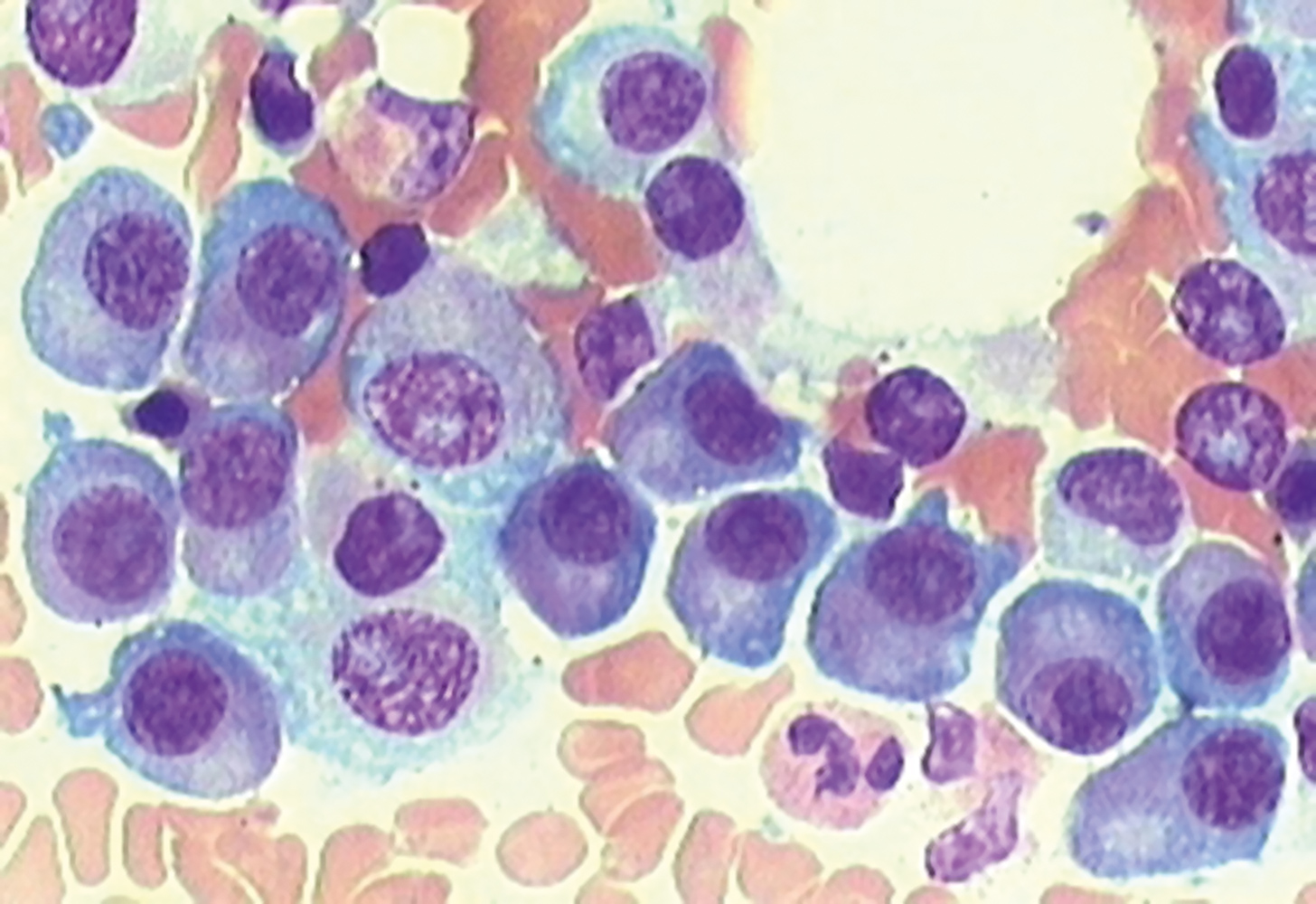
Im Knochenmark-Ausstrichpräparat sind die vielen, hier violetten Plasmazellen eines Myelom-Patienten zuerkennen. Bei Gesunden darf höchstens jede 20. Knochenmarkzelle eine Plasmazelle sein.
Resistenzen bei der CAR-T-Zell-Therapie Allerdings kann es bei der Behandlung von Myelom-Erkrankten mit CAR-T-Zellen auch zu schweren Rückfällen kommen. Auf der Suche nach den Ursachen deckten Forschende der Med II und des Würzburger Helmholtz-Instituts für RNA-basierte Infektionsforschung einen Resistenzmechanismus auf, den sie im Februar 2021 in der Fachzeitschrift Nature Medicine veröffentlichten. Nach Auffassung der Wissenschaftlerinnen und Wissenschaftler kann die CAR-T-Zell-Therapie eine ungewollte Selektion hervorrufen. Neben der riesigen Mehrheit der Myelom-Zellen mit BCMA gab es bei den fraglichen Fällen wahrscheinlich schon vor der Behandlung mit CAR-T-Zellen vereinzelt eine genetische Variante ohne diese wichtige Zielstruktur. Während die Zellen mit BCMA erfolgreich aufgespürt und eliminiert wurden, hatten die verbleibenden Zellen ohne BCMA einen so hohen Überlebensvorteil, dass sie sich in der Folge sprunghaft ausbreiten konnten. Dieses Wissen kann sich auf die Gestaltung künftiger Therapien auswirken: Vieles spricht dafür, dass man mit CAR-T-Zellen nicht nur gegen ein spezifisches Antigen feuern sollte, sondern vielmehr zwei oder sogar drei Ziele gleichzeitig adressieren muss.
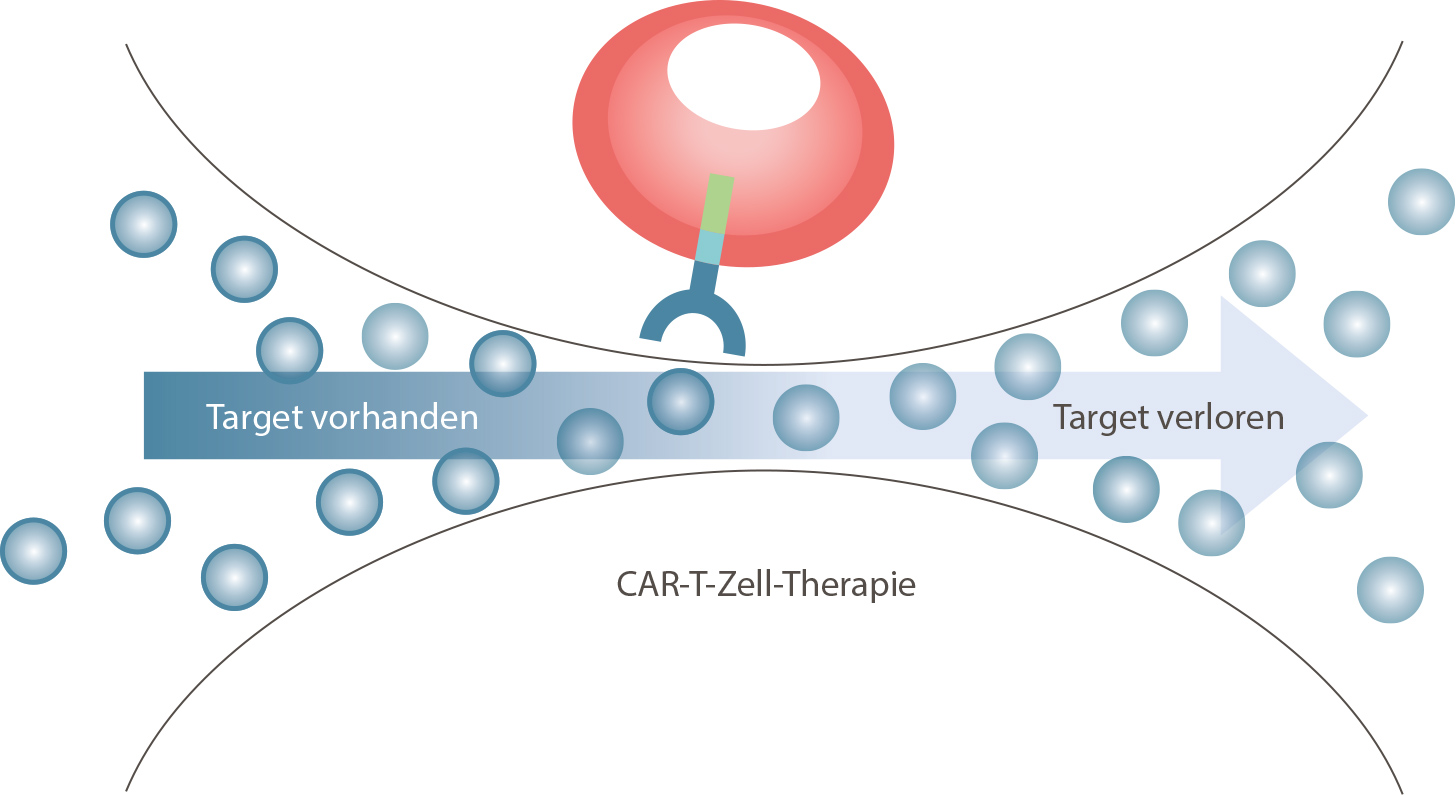
Die Myelom-Zellen mit BCMA-Expression (Target, blauer Ring) werden durch die CAR-T-Zell-Therapie vernichtet, während die zunächst vereinzelten Myelom-Zellen ohne BCMA-Expression (ohne Ring) unangetastet bleiben. Der Selektionsdruck der Therapie gibt diesen im Anschluss die Chance zu massenhafter Vermehrung.
Kombi-Therapie als neue, optimierte Behandlungsoption Bei der Therapie des schon stark vorbehandelten MM ist es für die Betroffenen vorteilhaft, die etablierte Gabe des Immunmodulators Pomaidomid und des Glucocorticoids Dexmethason um den monoklonalen Antikörper Daratumumab zu ergänzen. Das ist das Ergebnis einer multizentrischen internationalen Phase III-Studie, an der das UKW sowohl konzeptionell, wie auch durch den Einschluss von Patientinnen und Patienten beteiligt war. Veröffentlicht wurde sie im Juni 2021 in The Lancet Oncology.
Die zusätzliche, subkutane Gabe von Daratumumab verbessert die Überlebenschancen bei fortgeschrittenem Multiplem Myelom.
Bilder: Janssen-Cilag GmbH / UKW