Klinische Studien:
Vom Labor ans Krankenbett – und zurück
In klinikum & wir berichten wir regelmäßig – auch in dieser Ausgabe – über spannende Ergebnisse aus patientenorientierten Studien, die unter Leitung oder Mitwirkung des Uni klinikums Würzburg durchgeführt wurden. Grund genug, in diesem Topthema die Hintergründe von klinischen Studien näher zu beleuchten. Wie laufen diese ab? Wer führt sie durch? Und was haben die teilnehmenden Patient*innen davon?

Vor allem medizinische Innovationen haben dazu geführt, dass sich die Lebenserwartung in Deutschland seit Beginn des 20. Jahrhunderts in etwa verdoppelt hat. „Der wichtigste Motor hinter diesem Fortschritt ist die von den Medizinischen Fakultäten und den Universitätsklinika betriebene klinische Forschung“, unterstreicht Prof. Dr. Matthias Frosch, der Dekan der Medizinischen Fakultät der Uni Würzburg. Und Prof. Dr. Jens Maschmann, der Ärztliche Direktor des Uniklinikums Würzburg (UKW), ergänzt: „Auch in Würzburg können wir stolz sein auf viele Einrichtungen und Akteure, die in klinischen Studien daran mitarbeiten, zukünftige Patienten noch besser therapieren zu können.“ Aber wie läuft klinische Forschung im Detail ab? Welche Studienarten gibt es? Wer führt sie durch – und wie ist die Sicherheit der Patient*innen und Proband*innen gewährleistet? Erste Antworten dazu gibt klinikum & wir im folgenden Überblicksbeitrag. Da die Komplexität des Themas und die Vielzahl der in der Würzburger Universitätsmedizin Beteiligten den Rahmen dieses Artikels sprengen würden, ist dies der Auftakt für eine weiterführende Reihe in den kommenden Ausgaben. Was zählt zur klinischen Forschung? Nach einer Definition des Wissenschaftsrats zur klinischen Forschung in den Hochschulen umfasst klinische Forschung „in einem weiten Sinne alle Formen der Erforschung von Ursachen, Entstehung und Verlauf von Krankheiten sowie die wissenschaftliche Beschäftigung mit ihrer Erkennung und Behandlung.“ Beispielsweise verlangt der Gesetzgeber, dass jedes neue Medikament, Medizinprodukt oder Therapieverfahren zunächst seine Sicherheit und Wirksamkeit unter Beweis stellt, ehe es in breitem Umfang bei Patienten zum Einsatz kommen darf. In klinischen Prüfungen wird es dafür unter streng kontrollierten Bedingungen getestet. Daneben gibt es diagnostische und klinisch-epidemiologische Studien sowie Studien der Versorgungsforschung.
Bis ein neues Präparat in die Regelversorgung eingeht, vergehen üblicherweise viele Jahre, wobei Kosten von mehreren hundert Millionen Euro entstehen können. „Auf diesem langen Weg schaltet sich – nach der Grundlagen- und präklinischen Forschung – die klinische Forschung mit vier Phasen ein“, berichtet Prof. Dr. Peter Heuschmann, der Wissenschaftliche Leiter der Zentrale für Klinische Studien Würzburg (ZKSW, siehe Kasten auf S. 10). Die Tabelle unten liefert einen Überblick über die Struktur und die Ziele der jeweiligen Phase. Wie werden klinische Studien in Auftrag gegeben und finanziert? Der Auftraggeber einer klinischen Studie heißt Sponsor. Der Sponsor kann eine Person, eine Institution oder eine Organisation sein. Anders als in der Kultur- oder Sportförderung gehen die Aufgaben eines Sponsors von klinischen Studien deutlich über die Finanzierung hinaus. So trifft er die Entscheidung, eine Studie durchzuführen und leitet die entsprechenden formalen Schritte zur Studieninitiierung ein. Er übernimmt die Gesamtverantwortung für die Studie, aber nicht notwendigerweise die Finanzierung selbst. Außerdem ist er für das Studienmanagement verantwortlich. In Abgrenzung zum Sponsor verantwortet der Prüfarzt die Durchführung der klinischen Prüfung im Prüfzentrum.
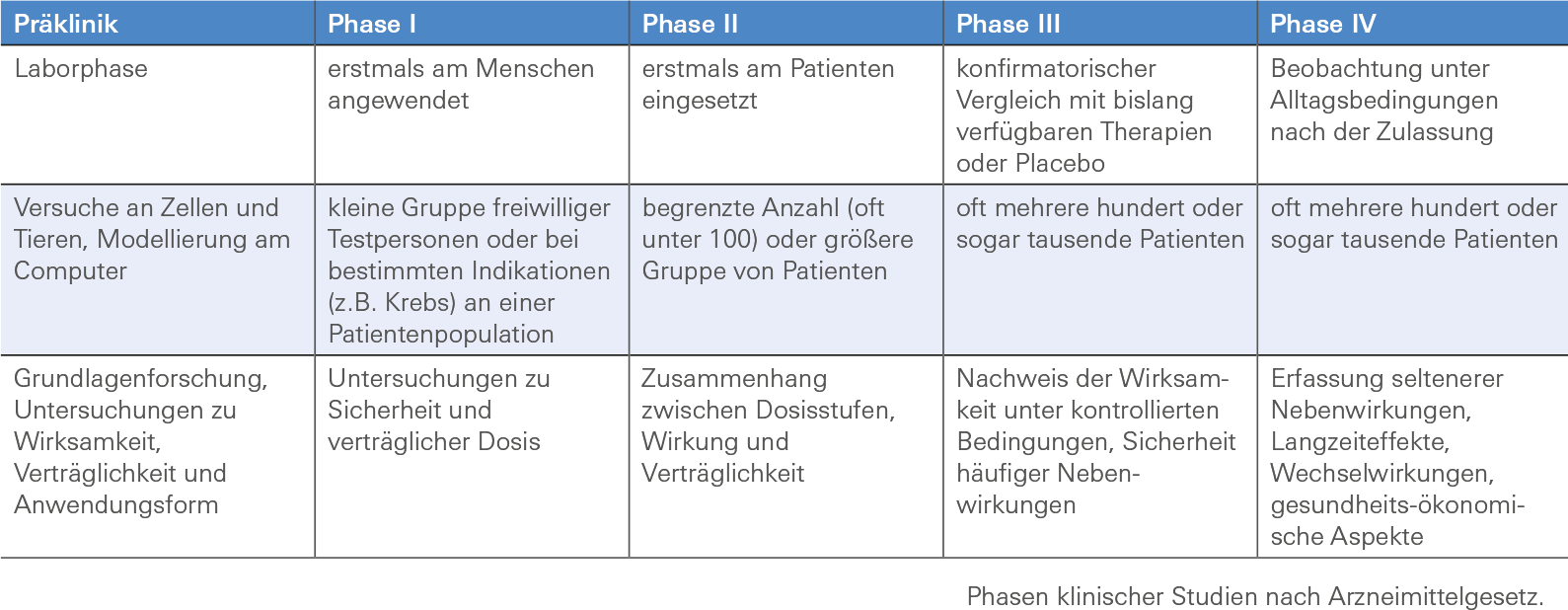
Präklinik
Laborphase
Versuche an Zellen und Tieren, Modellierung am Computer
Grundlagenforschung, Untersuchungen zu Wirksamkeit, Verträglichkeit und Anwendungsform
Phase I
erstmals am Menschen angewendet
kleine Gruppe freiwilliger Testpersonen oder bei bestimmten Indikationen (z.B. Krebs) an einer Patientenpopulation
Untersuchungen zu Sicherheit und verträglicher Dosis
Phase II
erstmals am Patienten eingesetzt
begrenzte Anzahl (oft unter 100) oder größere Gruppe von Patienten
Zusammenhang zwischen Dosisstufen, Wirkung und Verträglichkeit
Phase III
konfirmatorischer Vergleich mit bislang verfügbaren Therapien oder Placebo
oft mehrere hundert oder sogar tausende Patienten
Nachweis der Wirksamkeit unter kontrollierten Bedingungen, Sicherheit häufiger Nebenwirkungen
Phase IV
Beobachtung unter Alltagsbedingungen nach der Zulassung
oft mehrere hundert oder sogar tausende Patienten
Erfassung seltenerer Nebenwirkungen, Langzeiteffekte, Wechselwirkungen, gesundheits-ökonomische Aspekte
Phasen klinischer Studien nach Arzneimittelgesetz.
In Abhängigkeit vom Sponsor kann man kommerzielle und nichtkommerzielle Studien unterscheiden. Kommerzielle Studien werden von Industrieunternehmen in Auftrag gegeben und finanziert.
Nicht-kommerzielle Studien werden von Wissenschaftler*innen veranlasst und häufig aus Drittmitteln finanziert. Drittmittel sind Gelder, die die Forscher*innen zusätzlich zum regulären Hochschulhaushalt von öffentlichen oder privaten Stellen einwerben. Potenzielle Quellen sind öffentliche Einrichtungen, wie die Deutsche Forschungsgemeinschaft (DFG) oder das Bundesministerium für Wissenschaft und Forschung sowie Pharma- oder Medizintechnikunternehmen, mit denen die Wissenschaftler*innen zusammenarbeiten. So ist es möglich, dass auch eine wissenschaftsinitiierte Studie zumindest teilweise von einer Firma finanziert wird.
Bei klinischen Studien, für die das UKW selbst die Rolle des Sponsors übernehmen soll, kommt die Sponsorkommission ins Spiel. Hinter dem Gremium stehen der Geschäftsbereich 1 „Forschungsförderung und Drittmittelmanagement“ unter Leitung von Dr. Andrea Thelen-Frölich und die ZKSW unter der Geschäftsführung von Klemens Hügen. Dieser erläutert: „Die Sponsorkommission bewertet die Unterlagen klinischer Prüfungen hinsichtlich der Übereinstimmung mit den geltenden rechtlichen Regelungen, der Berücksichtigung nationaler und internationaler Qualitätsstandards und der gesicherten Finanzierung. Anschließend geben wir gegenüber dem Ärztlichen Direktor eine Empfehlung zur Übernahme oder Ablehnung der Sponsorenrolle ab.“ Darüber hinaus berät die Sponsorkommission die Initiatoren geplanter wissenschaftsinitiierter klinischer Studien.
Der Geschäftsbereich „Forschungsförderung und Drittmittelverträge“ übernimmt hier insbesondere die rechtliche Betreuung von Drittmittelprojekten am UKW und begleitet die rechtliche Umsetzung der klinischen Studie, zum Beispiel durch das Einbinden von Prüfzentren und weiteren Beteiligten oder durch Vertragsverhandlungen mit finanziellen Förderern. Dabei achten die Experten auch auf die Wahrung der rechtlichen Interessen des Klinikums. „Wir sorgen zum Beispiel dafür, dass die Haftungsregelungen ausgewogen sind und das Klinikum die Nutzungs- und Veröffentlichungsrechte der Projekteergebnisse für wissenschaftliche Zwecke behält“, verdeutlicht Dr. Thelen-Frölich.
Die Zentrale für Klinische Studien Würzburg berät die Projektleiter*innen zur Studieneinordnung. Außerdem übernimmt sie die Kostenplankalkulation und die Kostenplanprüfung.
Interventionelle und nicht-interventionelle Studien
Grundsätzlich lassen sich klinische Studien in interventionell und nicht-interventionell unterscheiden. Bei einer interventionellen Studie erfahren die Teilnehmenden eine prospektive Behandlung – zum Beispiel durch die Einnahme eines neuen Medikaments – nach einem klar festgelegten Studienprotokoll. Zudem werden die Patient*innen anhand von definierten Einschlusskriterien für die Teilnahme an der klinischen Studie ausgewählt.
In nicht-interventionellen Studien (NIS) wird eine Behandlung gemäß Zulassung oder Therapiestandard durchgeführt – also ohne Prüfplan (und damit ohne Intervention) sowie ohne limitierende Einschlusskriterien. Diese Studien sollen die Anwendung eines neu zugelassenen Therapieverfahrens im klinischen Alltag beobachten und daraus zusätzliche Erkenntnisse im Langzeitverlauf gewinnen, beispielsweise zur Dauer der Wirksamkeit, zu Nebenwirkungen und zur, Lebensqualität. Zu diesen NIS gehören auch Kohortenstudien, in denen große Patientenpopulationen in einem bestimmten Indikationsgebiet bezüglich des Krankheitsverlaufs oft über eine lange Zeit hinweg beobachtet werden. In diesem Beitrag konzentrieren wir uns auf interventionelle Studien.
Wodurch werden klinische Studien sicher? Seit der Deklaration von Helsinki aus dem Jahr 1964 muss das Studienprotokoll jeder klinischen Studie einer besonders berufenen, von Studienärzten und Auftraggebern unabhängigen Ethik-Kommission vorgelegt werden. Vorsitzender der Ethik-Kommission der Uni Würzburg ist Prof. Dr. Roland Jahns. Der Direktor der Interdisziplinären Biomaterial- und Datenbank Würzburg erläutert: „Die Ethik-Kommission muss den Nutzen einer Studie sorgfältig gegen die möglichen Risiken für die teilnehmenden Patienten und Probanden abwägen. Wir prüfen, ob die medizinischen Einrichtungen, an denen die Studie durchgeführt werden soll, und deren ärztliches Personal dafür auch geeignet sind. Zudem kontrollieren wir, ob die Texte zur Aufklärung über die Studie und zur schriftlichen Einwilligung in die Studien-Teilnahme verständlich und vollständig sind. Erst, wenn das alles erfüllt ist, geben wir unsere Zustimmung.“
Für diese Aufgaben ist die Kommission interdisziplinär besetzt. Ihr gehören Ärztinnen und Ärzte, ein Laienvertreter sowie Fachleute für Ethik und Recht an. Die nach Landesrecht gebildete Ethik-Kommission hat im Arzneimittelrecht (AMG) und Medizinprodukterecht (MPG) die Funktion einer Behörde.
Neben einer zustimmenden Bewertung durch die Ethik-Kommission ist für die allermeisten klinischen Studien auch eine Genehmigung durch die Bundesoberbehörde (BOB) erforderlich. Hierzu gehören das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder das Paul-Ehrlich-Institut (PEI). Welche Vorteile haben Studienpatient*innen? Patient*innen in klinischen Studien tragen wesentlich zum medizinischen Fortschritt bei – zum Wohle unserer Gesellschaft, in einer größer gefassten Perspektive sogar der gesamten Menschheit. Aber auch für sie selbst sind mit einer Studienteilnahme viele Vorteile verbunden. „Gerade für Patientinnen und Patienten, die auf zugelassene Therapien nicht ansprechen oder mit starken Nebenwirkungen reagieren, können Behandlungen in Studien neue Therapiemöglichkeiten eröffnen“, sagt Prof. Dr. Hermann Einsele. Der Direktor der Medizinischen Klinik II des UKW fährt fort: „Mit diesen besteht für sie die Chance, dass Beschwerden gelindert sowie im Idealfall Erkrankungen geheilt oder zumindest aufgehalten werden können.“ Außerdem profitieren Studienpatient*innen von einer individuellen, sehr engmaschigen und in der Hand einer Studienärztin oder eines Studienarztes liegenden Betreuung. So können Nebenwirkungen und gesundheitliche Veränderungen schnell erkannt sowie rasch Therapiemodifikationen vorgenommen oder das Nebenwirkungsmanagement optimiert werden.
Wer führt am UKW klinische Studien durch oder ist daran beteiligt? Klinische Studien sind am UKW geradezu ein „Querschnittsthema“. Zahlreiche Kliniken betreiben Studienambulanzen und verschiedene Stationen sind involviert, falls eine Studienpatientin oder ein Studienpatient stationär aufgenommen werden muss. Diverse Kliniken und Institute unterstützen durch Diagnostikleistungen die wissenschaftlichen Vorhaben – angefangen von Lungenfunktionsmessungen, über Biopsien und Echokardiografien bis zu den Schnittbildern aus der Magnetresonanz- und Computertomographie. Viele weitere Einrichtungen tragen zur Durchführung und letztlich zum Erfolg von klinischen Studien bei. Beispielsweise bereitet die Apotheke des Klinikums die Studienmedikamente gemäß Studienprotokoll zu und stellt die vorschriftsmäßige Lagerung der Prüfmedikamente sicher. Die Transfusionsmedizin steht für Zellentnahmen an den Patient*innen zur Verfügung. Die Zellen können vom GMP-Zelltherapie-Labor des UKW prozessiert und für innovative Immuntherapien genutzt werden. Bei der Geräteausstattung kommt die Abteilung Medizintechnik ins Spiel. Interdisziplinäres Studienzentrum mit Early Clinical Trial Unit Zu den Einrichtungen des Uniklinikums Würzburg, an denen schon seit langem mit hoher internationaler Sichtbarkeit klinische Studien durchgeführt werden, gehört das am Comprehensive Cancer Center (CCC) Mainfranken und der Medizinischen Klinik II angesiedelte Interdisziplinäre Studienzentrum mit Early Clinical Trial Unit (ISZ/ECTU). Seit über 15 Jahren konzentriert sich die interdisziplinäre klinische Einheit ausschließlich auf die Durchführung neuer und experimenteller Therapieansätze bei onkologischen Patient*innen. „Klinische Forschung ist dann erfolgreich, wenn sie die Menschen erreicht“, sagt Dr. Maria-Elisabeth Goebeler. Die Leiterin des Interdisziplinären Studienzentrums des ISZ fährt fort: „Medizinische Forschungsergebnisse müssen in innovative Studien überführt werden, damit sie in der alltäglichen Versorgung von Patienten in Kliniken und Praxen ankommen.“ Für diese erste Translation ist mit der ECTU eine auf Phase I Studien spezialisierte Einheit im Studienzentrum des CCC Mainfranken etabliert, über die Patienten im Rahmen von klinischen Studien einen sicheren Zugang zu neuesten Behandlungsverfahren erhalten unter professioneller Einhaltung aller regulatorischen Vorgaben. Besondere Erfahrung hat die ECTU in der Erstanwendung von Immuntherapien am Menschen (First-in Human Clinical Trial). Das betrifft unter anderem die Evaluation bispezifischer Antikörper, die diverse Tumorantigene adressieren, sowie von komplexen Immunkombinationstherapien. Außerdem wird ein breites Portfolio zellulärer Immuntherapien, zum Beispiel mit CAR-T-Zellen, in frühen klinischen Studien erprobt. Die Durchführung der klinischen Studien sowie vor allem die Betreuung der Studienpatient*innen in diesen überwiegend interdisziplinären und verschiedene Tumorerkrankungen adressierenden Projekten erfolgt in enger Kooperation mit den onkologisch arbeitenden Kolleg*innen der jeweiligen Fachkliniken des UKW. „Eine erfolgreiche Translation braucht ein gutes Zusammenwirken von Forschung und Praxis. Sie lebt von Kooperation und interdisziplinärem Austausch“, sagt Prof. Dr. Ralf Bargou, der Direktor des CCC Mainfranken. Frühe klinische Studien bedeuten für die Patient*Innen eine unmittelbare Teilhabe an medizinischer Innovation sowie eine nicht unerhebliche Chance auf eine verbesserte Lebensqualität, wenn nicht sogar auf ein längeres Überleben.
Was ist eigentlich…
… eine kontrollierte Studie? Bei einer kontrollierten Studie wird die neue Behandlung in der Regel mit dem aktuellen Behandlungsstandard oder mit einer Scheinbehandlung – einem Placebo – verglichen. Ein solches Placebo kann in einer Medikamentenstudie zum Beispiel ein Arzneimittel ohne Arzneistoff sein. Dieser Vergleich ist wichtig, um den tatsächlichen Effekt einer Therapie zuverlässig beurteilen zu können. … eine Randomisierung? Kontrollierte Interventionsstudien sollten möglichst randomisiert durchgeführt werden. Das bedeutet, dass die Teilnehmenden per Zufall in die unterschiedlichen Studiengruppen eingeteilt werden. Die Gruppe, die die neue Behandlung erhält, heißt Verumgruppe oder Behandlungsgruppe. Die Gruppe, die eine Placebo-Behandlung erhält, ist die Kontrollgruppe. … eine Doppelblindstudie? Verblindung bedeutet, dass die Patient*innen nicht wissen, ob sie in der Behandlungs- oder in der Kontrollgruppe sind. Bei einer doppelten Verblindung weiß auch die/der behandelnde Prüfärztin oder -arzt nicht Bescheid. Eine Verblindung verhindert, dass Erwartungen und Suggestionseffekte die Ergebnisse klinischer Studien verfälschen.
… ein Studienprotokoll? Im Studienprotokoll – oder auch Prüfplan – wird die Studie detailliert beschrieben. Unter anderen werden dort der wissenschaftliche Hintergrund, das Studiendesign, die Zielparameter, die genaue Vorgehensweise, Ein- und Ausschluss- und Abbruchkriterien, Sicherheitsaspekte, Qualitätssicherungs- und -kontrollmaßnahmen sowie wichtige Adressen festgehalten. … ein Prüfarzt / eine Prüfärztin? Prüfarzt ist eine ärztliche Zusatzqualifikation. Prüfärzt*innen sind vor allem an der Planung, Organisation und Durchführung klinischer Studien beteiligt. Zu ihren Aufgaben zählen – neben der Behandlung der Studienpatient*innen gemäß Studienprotokoll – die Datenerhebung und die Qualitätssicherung. Die hierfür erforderlichen ethischen, rechtlichen und methodischen Grundlagen werden in gesetzlich vorgeschriebenen Kursen vermittelt. … eine Study Nurse? Study Nurses oder Studienassistent*innen betreuen Patient*innen oder Proband*innen während einer klinischen Studie und haben neben den berufstypischen Aufgaben der Gesundheits- und Krankenpflege zusätzlich koordinative Aufgaben. Sie unterstützen Prüfärzt*innen bei der Studiendurchführung und bei administrativen Tätigkeiten. Um dafür gerüstet zu sein, müssen Study Nurses einen Kurs zur „Guten klinischen Praxis“ (Good Clinical Practice – GCP) absolvieren und erhalten zudem die Möglichkeit, eine spezielle Study-Nurse-Weiterbildung zu besuchen.
Medizinische Klinik I inklusive DZHI Die Schwerpunkte in der Medizinischen Klinik und Poliklinik I (kurz Med I) des UKW liegen in den Disziplinen Endokrinologie, Intensiv-/Notfallmedizin, Kardiologie, Nephrologie und Pneumologie. Die Schwerpunkte sind stark in klinische Studien involviert. Im Bereich Endokrine Tumore zählt das Team um Prof. Dr. Martin Fassnacht zu einem der fünf größten Studienzentren der Welt, bei der Erforschung und Behandlung des Nebennierenkarzinoms ist es führend. Alle wesentlichen Therapiemodifikationen, die bei dieser seltenen und äußerst bösartigen Erkrankung in den vergangenen 20 Jahren erzielt werden konnten, gingen von der Med I aus oder erfolgten unter ihrer maßgeblichen Mitbeteiligung. Strukturell profitieren die Endokrinologen der Med I stark von der Kooperation mit der ECTU.
Die klinischen Studien in der Kardiologie und Nephrologie werden hauptsächlich am Deutschen Zentrum für Herzinsuffizienz (DZHI) durchgeführt oder durch dieses organisiert. Das dort ansässige Clinical Trial Office fungiert für Deutschland als nationale Koordinierungsstelle in Global Mega-Trials, also großen randomisierten Studien mit Beteiligung von vielen hundert Studienzentren und vielen tausend Patient*innen. Das Clinical Trial Office ist dabei eingebunden in sämtliche Phasen, die eine solche Studie dabei durchläuft.
„Eine langjährige und erfolgreiche Zusammenarbeit findet zum Beispiel mit der University of Oxford statt“, schildert der Leiter der Nephrologie, Prof. Dr. Christoph Wanner. „Derzeit untersuchen wir gemeinsam in der Studie EMPA-Kidney, ob der Wirkstoff Empagliflozin positive Auswirkungen auf die Niere hat, die Notwendigkeit einer Dialysebehandlung verringert und schlussendlich Leben rettet.“ Christoph Wanner war der erste weltweit, der das Potenzial von SGLT2-Hemmern wie Empagliflozin entdeckte.
Neben nationalen und internationalen Studien führt die Klinische Studieneinheit am DZHI auch kleinere Studien durch. So hat das DZHI in den vergangenen zehn Jahren mehr als 10.000 Patienten in mehr als 100 Studien betreut. In der an die Med I angeschlossenen Herzinsuffizienz-Ambulanz werden neben der klinischen Routine täglich etwa 14 Studienvisiten durchgeführt.
„Eine zentrale Idee ist es, die Nutzung von routinemäßig erhobenen Daten und Biomaterialien für patientenrelevante Forschungsprojekte zu erleichtern“, kommentiert Prof. Dr. Stefan Störk, Leiter des Departments Klinische Forschung und Epidemiologie am DZHI. Alle Behandlungsdaten aus den verschiedenen Spezialsprechstunden werden so detailliert aufbereitet, dass sie unmittelbar für die Forschung verwertbar sind. Idealtypisch zeigt sich dies bei den großen Krankheitsregistern, die Patienten über eine lange Zeit begleiten. Das DZHI hat hier eine Vorreiterrolle in der Registerforschung. So steht denn auch das Motto von Prof. Störk für eine beispielhafte Integration von Forschung in den klinischen Behandlungsalltag: „Der am besten beforschte Patient ist der am besten umsorgte Patient.“ Medizinische Klinik II An der Medizinischen Klinik und Poliklinik II (Med II) werden für viele, überwiegend onkologische Krankheitsbilder – aber auch in der Hepatologie, Gastroenterologie, Rheumatologie und klinischen Infektiologie – innovative Therapien im Rahmen von klinischen Studien angeboten. Dazu gehören neue zellbasierte Immuntherapien (CAR-T-Zellen, T-Zell-aktivierende Antikörper), die als Phase I/II Studien besonders überwacht werden müssen. Hierfür stehen die Transplantationsstation M52 (vor allen bei akuten Leukämien und Multiplem Myelom) und die Intermediate-Care-(IMC)-Station M41 zur Verfügung. Auf der IMC-Station werden zudem Phase I/II Studien mit bispezifischen Antikörpern und CAR-T-Zellen bei Patient*innen mit Lymphom oder Akuter lymphatischer Leukämie durchgeführt.
Für Phase III Studien stehen in der Med II krankheitsspezifische Studienzentralen zur Verfügung, beispielsweise für Infektions-, Leber- und rheumatologische Erkrankungen, Tumore des Magen-Darm-Traktes und andere solide Tumoren oder bei Multiplem Myelom. Die Expert*innen der Studienzentralen an der Med II leiten oder koordinieren vielfach große multizentrische, zum Teil auch international aufgestellte Studien. Diese können bis zu 1000 Patient*innen umfassen und haben bereits zur – auch weltweiten – Zulassung mehrerer Medikamente geführt. Beispiele sind neue antivirale Substanzen, gegen Pilze gerichtete Medikamente, aber auch Kombinationstherapien beim Bauchspeicheldrüsen-Krebs oder neue Immuntherapien beim Lymphknotenkrebs, der akuten Leukämie und dem Multiplen Myelom.
„Als eines der wenigen Universitätsklinika in Deutschland begleiten wir in Würzburg auch eigenentwickelte Therapien bis in die Anwendung beim Patienten“, berichtet Klinikdirektor Hermann Einsele. Ein Beispiel dafür ist das von der Med II geleitete, multinational aufgestellte Vorhaben CARAMBA. Dieses zielt darauf ab, ein von Prof. Dr. Michael Hudecek entwickeltes CAR-T-Zell-Produkt für die Behandlung des Multiplen Myeloms in die klinische Anwendung zu überführen.
„Zukünftig werden unsere Eigenentwicklungen in der klinischen Krebsforschung zusätzlich über das Nationale Centrum für Tumorerkrankungen Würzburg, Erlangen, Regensburg und Augsburg – kurz NCT WERA – finanziert werden. Für NCT-weite Studien werden dazu erhebliche Mittel zur Verfügung stehen“, kündigt Prof. Einsele an, der das NCT WERA am Standort Würzburg koordiniert. Den Studienteilnehmer*innen sei Dank „Trotz all dem am UKW erbrachten organisatorischen, intellektuellen und medizinischen Aufwand leisten nach meiner Auffassung die Patientinnen und Patienten den größten Beitrag zum Erfolg der klinischen Studien“, betont Prof. Maschmann. Der Ärztliche Direktor weiß nur zu gut, dass diese – trotz ihrer oft schweren Erkrankungen – viele zusätzliche Studienvisiten auf sich nehmen, unter Umständen zahlreiche Zusatzuntersuchungen durchführen lassen und geduldig umfangreiche Fragebögen ausfüllen. „Gerne nutze ich die Gelegenheit, an dieser Stelle allen Studienteilnehmerinnen und -teilnehmern meinen Respekt auszudrücken und – praktisch im Namen unserer gesamten Gesellschaft – herzlichst zu danken“, so Maschmann.
Rund 110 interventionelle Studien pro Jahr
Am Uniklinikum Würzburg werden jährlich durchschnittlich 300 Studien initiiert. Ein Drittel davon sind klinische Prüfung entsprechend dem Arzneimittelgesetz oder dem/der Medizinproduktegesetz / Medizinprodukteverordnung. Der Großteil sind Forschungsvorhaben, die der berufsrechtlichen Beratung durch die Ethik-Kommission unterliegen.
Die Zentrale für Klinische Studien Würzburg
Die Zentrale für Klinische Studien Würzburg (ZKSW) ist ein zentraler Partner der forschenden Einrichtungen des UKW. Sie unterstützt die Wissenschaftler*innen und deren Kooperationspartner*innen von der ersten Idee zu einer klinischen Studie bis zur Auswertung und Publikation der Ergebnisse. Gemeinsam werden das Studiendesign und ein tragfähiges Konzept entwickelt sowie Drittmittel eingeworben. Die Hilfestellungen setzen sich in der Vorbereitungs- und Durchführungsphase fort. Darüber hinaus bietet die ZKSW Weiterbildungskurse für das Studienpersonal an.