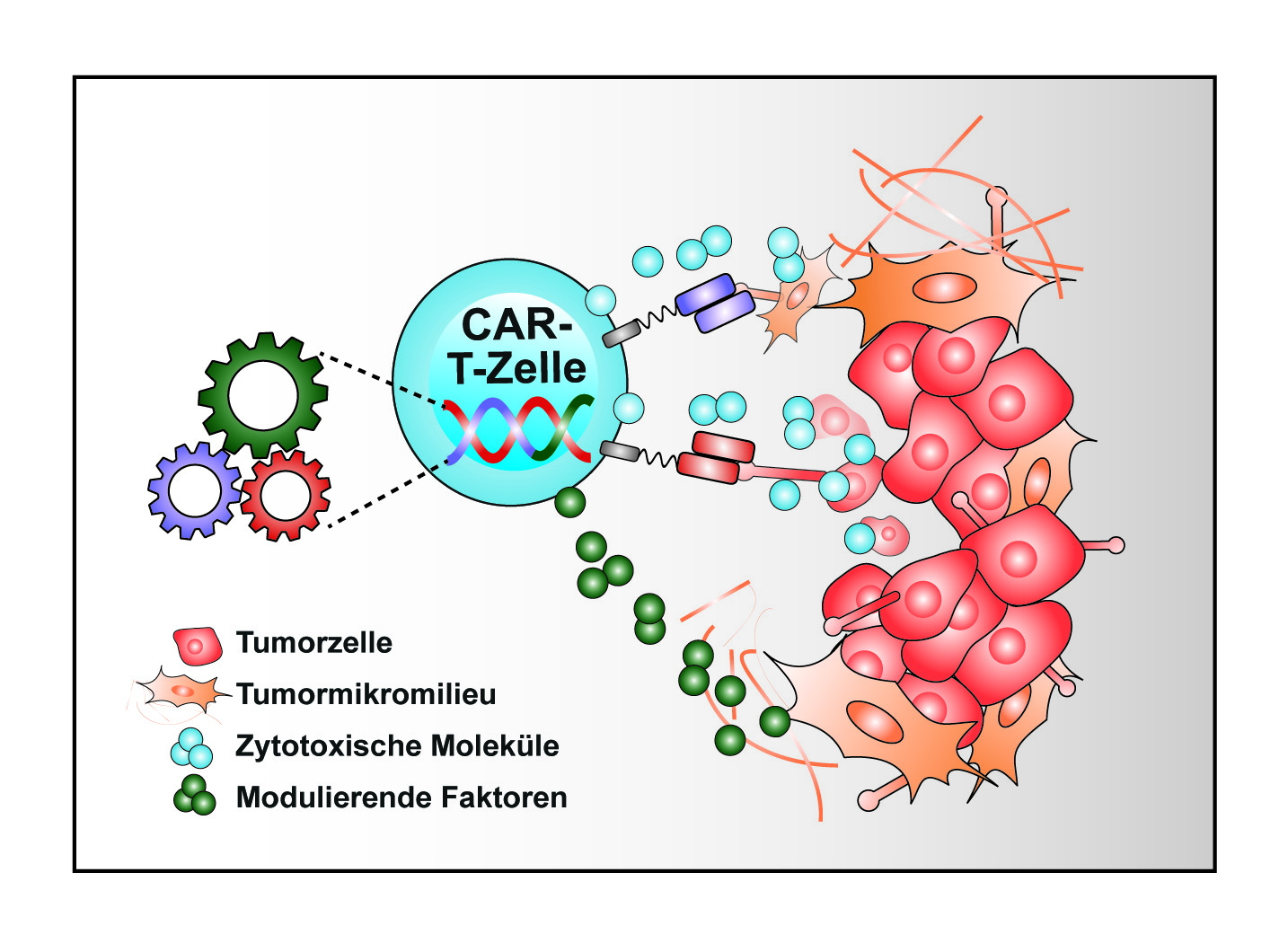
Jedes Jahr erhalten allein in Deutschland rund 7.000 Menschen die Diagnose Multiples Myelom. Dauerhaft geheilt werden kann diese Krebserkrankung, die von veränderten Plasmazellen im Knochenmark ausgeht, noch nicht. Denn auch nach vermeintlich erfolgreicher Therapie müssen die Betroffenen immer mit einem Rezidiv rechnen. Als große Hoffnungsträger gelten Immuntherapien mit Antikörpern oder Gen-manipulierten T-Zellen, den so genannten CAR-T-Zellen. Prof. Dr. Hermann Einsele, Direktor der Medizinischen Klinik und Poliklinik II des Universitätsklinikums Würzburg und Sprecher des neu gegründeten NCT WERA, hat eine internationale Studie mitkonzipiert und entwickelt, die jetzt erstmals in randomisierter Form eine Überlegenheit der CAR-T-Zelltherapie gegenüber einer konventionellen Behandlung beim fortgeschrittenen Multiplen Myelom (in der 2. und 4. Therapielinie) gezeigt hat. Die Ergebnisse wurden im New England Journal of Medicine (doi: 10.1056/NEJMoa2303379) veröffentlicht und gerade auf dem europäischen Hämatologen-Kongress in Frankfurt (European Hematology Congress EHA 2023) als Meilenstein in der Myelom-Therapie bewertet.
Patienten, die auf Lenalidomid refraktär waren, profitierten von einmaliger Cilta-Cel-Infusion
In der Phase-3-Studie CARTITUDE-4 wurden Patientinnen und Patienten mit einem Lenalidomid-refraktären Multiplen Myelom entweder mit der CAR-T-Zelltherapie Ciltacabtagene Autoleucel, kurz Cilta-Cel, oder mit einer wirksamen Standardtherapie nach Wahl des Behandelnden therapiert. „Der Einsatz von Lenalidomid ist als Frühtherapie und auch als Erhaltungstherapie weit verbreitet“, erläutert Hermann Einsele. „Jedoch entwickeln die Betroffenen häufig eine Resistenz gegen den Immunmodulator, sodass sie auf diese Therapie nicht mehr ansprechen. Bei Patienten mit einer Lenalidomid-refraktären Erkrankung ist die Prognose extrem ungünstig, das mediane erkrankungsfreie Überleben bei bisherigen Therapien liegt bei unter zwölf Monaten. Daher besteht ein dringender Bedarf an neuen, frühzeitig wirksamen Therapien.“
Geringeres Risiko für Fortschreiten des Multiplen Myeloms oder Tod
In früheren Studien wurde bereits gezeigt, dass die chimäre Antigenrezeptor-T-Zell-Therapie Cilta-Cel, die gegen das B-Zell-Reifungsantigen (BCMA) gerichtet ist, bei Personen mit rezidiviertem oder refraktärem Multiplem Myelom zu einem frühen langanhaltendem tiefen Ansprechen führt. „Im direkten Vergleich mit der Standardbehandlung konnten wir nun zeigen, dass die CAR-T-Zell-Therapie mit einer einzelnen Cilta-Cel-Infusion zu einem deutlich geringeren Risiko für ein Fortschreiten der Erkrankung oder den Tod führt“, freut sich Hermann Einsele, der bei der Studie als Letztautor fungiert.
Insgesamt wurden für die Phase-3-Studie 419 Patientinnen und Patienten randomisiert, 208 Personen erhielten die Behandlung mit Cilta-Cel und 211 die Standardtherapie. In der Intention-to-treat-Analyse betrug das progressionsfreie Überleben nach zwölf Monaten in der Cilta-Cel-Gruppe 75,9 % und in der Standardbehandlungsgruppe 48,6 %. In der Cilta-Cel-Gruppe wiesen außerdem mehr Personen als in der Standardbehandlungsgruppe ein Gesamtansprechen (84,6 % gegenüber 67,3 %), ein vollständiges Ansprechen oder besser (73,1 % gegenüber 21,8 %) und keine minimale Resterkrankung (60,6 % gegenüber 15,6 %) auf. Noch beeindruckender war die Per-Protokoll-Analyse der Patienten, welche tatsächlich mit einer CAR-T-Zell-Infusion behandelt wurden: Die Ansprechrate betrug 99,4 % - das heißt: nur 1 von 176 behandelten Patienten sprach nicht an. 86 % der Patienten konnten eine komplette Remission erreichen und 90 % waren nach zwölf Monaten noch krankheitsfrei.
Hoffnung auf längere Krankheitsfreiheit und Heilungsoptionen durch frühe Anwendung
„Die bisherigen Ergebnisse mit der CAR-T-Zell-Therapie beim Multiplen Myelom – nach 6 Linien Vorbehandlung ein krankheitsfreies Überleben von 34.9 Monaten – lassen erhoffen und vermuten, dass die hier erfolgte frühere Anwendung nach 1 bis 3 Vortherapien bei dem exzellenten Ansprechen noch deutlich längere Krankheitsfreiheit und sogar Heilungsoptionen eröffnet“, resümiert Hermann Einsele.