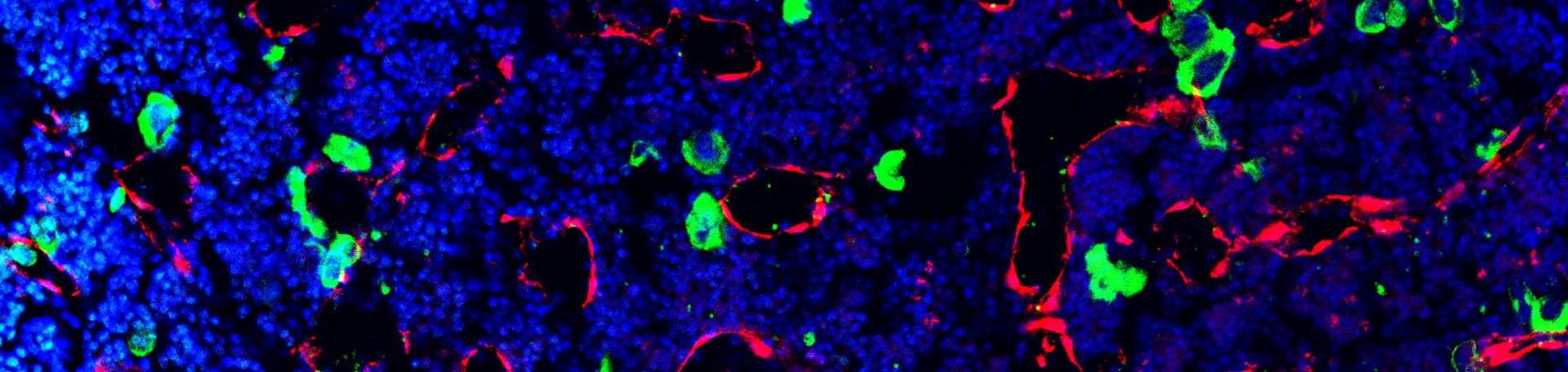
Rho GTPasen in Megakaryozyten und Thrombozyten
Nach einer Gefäßverletzung kommen zirkulierende Thrombozyten mit freiliegenden subendothelialen Matrixkomponenten in Kontakt und bilden einen Pfropfen, der einen übermäßigen Blutverlust verhindert. Daneben sind Thrombozyten jedoch auch an der Entstehung von pathologischen thrombotischen Ereignissen (zum Beispiel Herzinfarkt und Schlaganfall), entzündlichen Prozessen, und an der Tumorbiogenese beteiligt. Thrombozyten werden von riesigen Vorläuferzellen (Megakaryozyten) vornehmlich im Knochenmark gebildet. Dazu lagern sich reife Megakaryozyten von außen an Blutgefäße an und entsenden zytoplasmatische Ausläufer (Proplatelets) durch das Endothel in das Gefäß hinein. Im Gefäßlumen erfolgt dann die Abschnürung einzelner Thrombozyten durch die im Blut befindlichen Scherkräfte. Die molekularen Mechanismen, welche die polarisierte Lokalisation reifer Megakaryozyten und nachfolgend die gerichtete Proplatelet-Bildung in das Gefäß hinein steuern, sind bis heute nur unvollständig aufgeklärt.
Wir konnten in der Vergangenheit zeigen, dass GTPasen der Rho Proteinfamilie, RhoA, Cdc42 und Rac1, maßgeblich an der Steuerung der Thrombozytenfunktion und / oder der Thrombozytenbildung beteiligt sind. Rho GTPasen regulieren Zytoskelett-Umstrukturierungen sowie eine Vielzahl an intrazellulären Signalkaskaden. Die meisten Rho GTPasen unterliegen einem dynamischen Wechsel zwischen einem inaktiven, GDP-gebundenen, und einem aktiven, GTP-gebundenen Zustand, in dem sie eine Vielzahl an Effektoren binden können.
Unsere neuesten Erkenntnisse deuten darauf hin, dass Rho GTPasen Cdc42 und RhoA einen regulatorischen Schaltkreis bilden, der die gerichtete Proplatelet-Bildung durch das sinusoidale Endothel ermöglicht. Überdies zeigen vorläufige Ergebnisse, dass auch das RhoA-verwandte Protein RhoB in diese Prozesse involviert ist. Unter Verwendung verschiedener transgener Mausstämme und Krankheitsmodelle wollen wir nun die zugrundeliegenden molekularen Mechanismen im Detail aufklären. Unser langfristiges Ziel ist dabei nicht nur die spezifische Manipulation der Thrombozytenzahlen in Patientinnen und Patienten mit Thrombozytenbildungsstörungen (zum Beispiel beim Vorliegen von Chemotherapie oder Sepsis), sondern auch die verbesserte In-vitro-Produktion von funktionalen Thrombozyten für die Transfusionsmedizin.

