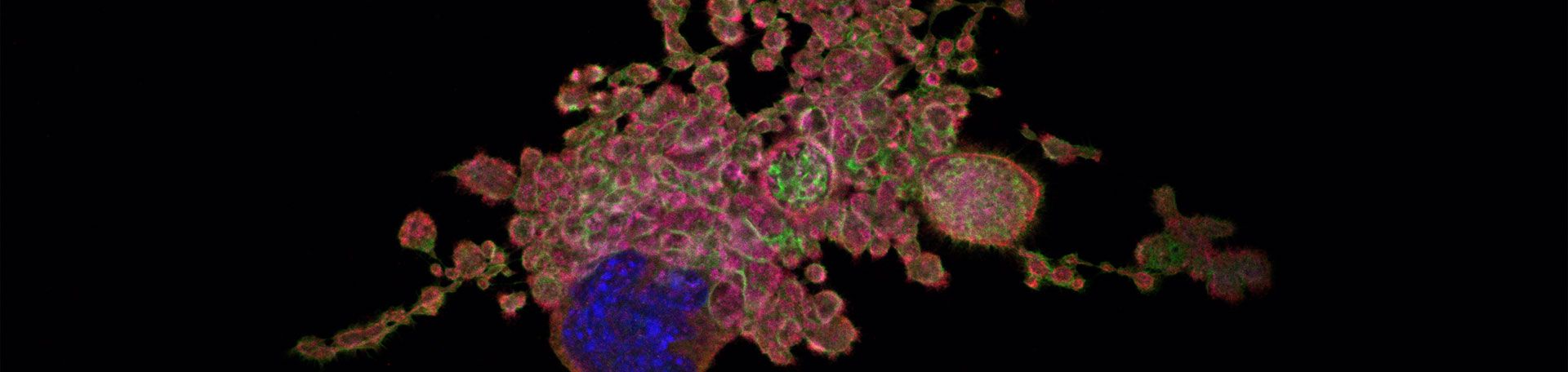
Zytoskelett-Proteine in Megakaryozyten und Thrombozyten
Nach einer Gefäßverletzung kommen zirkulierende Thrombozyten mit freiliegenden subendothelialen Komponenten in Kontakt, aggregieren und verschließen so die Wunde, um einen übermäßigen Blutverlust zu verhindern. 1011 Thrombozyten werden täglich im menschlichen Körper produziert um die normale hämostatische Funktion zu erfüllen. Thrombozyten werden von Megakaryozyten im Knochenmark in einem einzigartigen Prozess in der Säugetierphysiologie produziert. Megakaryozyten sind in unmittelbarer Nähe zu sinusoidalen Blutgefäßen lokalisiert und wandeln ihr zytoplasmatisches membranartiges Netzwerk in lange zytoplasmatische Ausläufer (Proplatelets) um, die sich in das Lumen von Knochenmarksgefäßen erstrecken. Schließlich werden Thrombozyten sequenziell von den Enden der Proplatelets freigesetzt. Bedingungen, die zu einer unzureichenden Thrombozytenproduktion oder ihrem beschleunigten Abbau führen, bergen ein Blutungsrisiko. Die Aufklärung der an der Thrombozytenbildung beteiligten Mechanismen würde neue therapeutische Möglichkeiten eröffnen.
Die Bildung von Thrombozyten ist ein Prozess, der maßgeblich von Zytoskelett-mechanischen Bedingungen beeinflusst wird. Daher untersuchen wir Zytoskelett-Komponenten (beispielsweise Aktin, Tubulin, Myosin) und Zytoskelett-regulatorische Proteine im Mausmodell sowie in Patientinnen und Patienten mit Thrombozytenfunktionsstörungen, um ihre Rollen bei der Bildung von Thromboyzten im Knochenmark zu identifizieren. Unsere Ergebnisse könnten neue Möglichkeiten für die Früherkennung und Behandlung von Krankheiten eröffnen, die durch einen Defekt der Thrombozytenbildung verursacht werden.
Nach der Freisetzung aus ihren Vorläuferzellen zirkulieren Thrombozyten im Blutstrom und überwachen die Integrität der Gefäßwand. Wenn die Thrombozytenaggregation unkontrolliert auftritt, kann sie jedoch zu thrombotischen Ereignissen führen, die lebensbedrohliche Krankheitszustände wie Myokardinfarkt oder ischämischen Schlaganfall verursachen, welche die Hauptursachen für Behinderung und Mortalität in der westlichen Welt sind. Daher besteht nach wie vor eine starke Nachfrage nach der Entwicklung und Produktion selektiver, starker und dennoch sicherer antithrombotischer Medikamente. Auch für die Thrombozytenfunktion spielen Zytoskelett-regulatorische Proteine eine fundamentale Rolle. Unser zweiter Forschungsschwerpunkt ist daher die Identifizierung von Zytoskelett-Schlüsselmolekülen, die an der Hämostase und der pathologischen Thrombusbildung sowie an thrombo-inflammatorischen Prozessen beteiligt sind.


