
Ein sehr hoher Anteil von Krebspatienten verstirbt nicht am initialen Tumor, sondern an den daraus entstehenden Metastasen. Das Wachstum dieser Absiedelungen lässt sich mit herkömmlichen Therapien häufig kaum mehr bremsen. Tumore des Dickdarms, aber auch viele andere Tumore, metastasieren häufig in die Leber. Neue Therapieansätze werden daher dringend gesucht und kämen einer großen Anzahl an Patienten zugute.
„Wir wollen unsere Expertise und unsere Techniken bündeln und das lokale Immunsystem der Leber erforschen: Wie kommunizieren und funktionieren verschiedenste Zellen vor Ort im gesunden Organ, und wie verändern sie sich im entarteten Gewebe. Ziel ist es, neue Strategien zu entwickeln, um das Potential der angeborenen Immunzellen in der Leber für die Behandlung von metastatischen Erkrankungen nutzbar zu machen,“ fasst der Immunologe Georg Gasteiger von der Max-Planck-Forschungsgruppe für Systemimmunologie an der Universität Würzburg und Sprecher des Teams den Forschungsansatz zusammen.
Ein Ansatz, in dem der European Research Council großes Potenzial sieht: Mit Synergy Grants werden ausschließlich hochinnovative, potenziell bahnbrechende Forschungsansätze gefördert, die weltweit neue Maßstäbe setzen könnten. Das Team um den Würzburger Immunologen konnte ein internationales Gutachtergremium mit seinen wissenschaftlichen Vorschlägen überzeugen und wird mit der Höchstsumme von 10 Mio. EUR für 6 Jahre gefördert.
Neu entwickelte Moleküle als Therapieansatz
Die vier Wissenschaftler forschen in Italien, Frankreich und Deutschland. Sie gelten jeweils als führend in ihrem Gebiet: Valeria Fumagalli ist Expertin für Leberimmunologie und arbeitet am Krankenhaus San Raffaele in Mailand mit Gewebeproben von Tumorpatienten. Florent Ginhoux vom Gustave Roussy Cancer Campus in Paris ist Experte für die Biologie von myeloiden Zellen, und wie sie im gesunden und kranken Gewebe funktionieren. Georg Gasteigers Arbeit konzentriert sich auf Lymphozyten des angeborenen Immunsystems, darunter sogenannte „Natürliche Killer“ oder NK-Zellen und wie sie sich entwickeln und in den verschiedenen Geweben des Körpers funktionieren. Eric Vivier vom Centre d'Immunologie in Marseille-Luminy hat bereits mehrere Moleküle entwickelt, mit denen diese Zellen für den Kampf gegen Tumorzellen aktiviert werden können – und diese erfolgreich in die klinische Erprobung an Patienten gebracht. Basierend auf diesen Erfahrungen, will das Team neue Ansätze der Immuntherapie entwickeln.
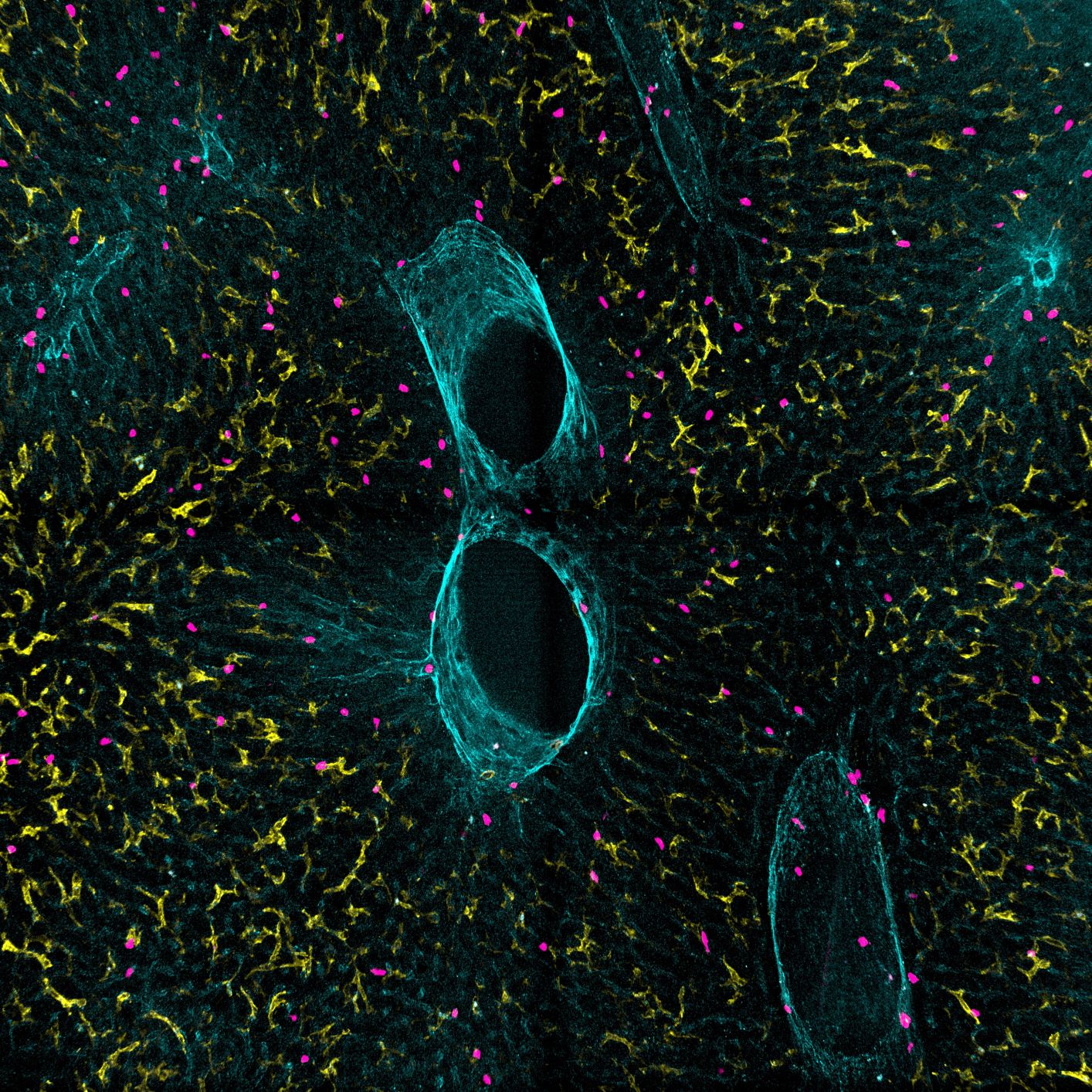
Die Wissenschaftler werden Gewebe- und Tumorproben von Patienten mittels modernster, hochauflösender Einzelzell- und räumlicher Transkriptomik untersuchen. Damit wollen sie die Kommunikation und Wechselwirkung von Immunzellen untereinander und mit den verschiedensten Zellen der Leber aufklären, und wie sich diese während der Erkrankung verändert. Ziel ist es, Schlüsselmoleküle und Schaltstellen in komplexen zellulären Interaktionsnetzwerken zu identifizieren, und diese für die Wiederherstellung der Immunkontrolle in den metastatischen Läsionen zu nutzen. Die Forscher planen, neue Moleküle zu entwickeln, mit denen sich die Interaktion zwischen den Zellen steuern lässt. Diese sollen dann in experimentellen Mausmodellen und an Gewebeproben von Patienten getestet werden, um neue Therapieansätze für diese verheerenden Krankheit zu testen. „Wir hoffen, dass solche Ansätze zur Modulation des lokalen Immunsystems in der Zukunft dann auch für andere Erkrankungen und Gewebe eingesetzt oder weiterentwickelt werden können,“ so Georg Gasteiger.
ERC Synergy Grants für wegweisende Forschung
Der European Research Council (ERC) ist die wichtigste europäische Förderorganisation für exzellente Pionierforschung. Er fördert kreative Forscher aller Fachrichtungen, Nationalitäten und jeden Alters, die Projekte in ganz Europa durchführen. Er wurde 2007 von der Europäischen Union gegründet und ist Teil des Programms „Horizon Europe“. Sein Gesamtbudget für den Zeitraum 2021 bis 2027 beläuft sich auf mehr als 16 Mrd. EUR.
Synergy Grants werden für Projekte vergeben, die das Know-how verschiedener Experten zusammenbringen und dadurch wesentliche Fortschritte an den Grenzen des Wissens ermöglichen, die beispielsweise auf vielversprechenden neuen Forschungsergebnissen oder Methoden und Techniken aufbauen, einschließlich unkonventioneller Ansätze und Untersuchungen an der Schnittstelle zwischen etablierten Disziplinen. Die durch Synergy Grants geförderte transformative Forschung soll das Potenzial haben, weltweit neue Maßstäbe zu setzen. Synergy Grants können bis zu einem Höchstbetrag von 10 Mio. EUR für einen Zeitraum von 6 Jahren gewährt werden.
Max-Planck-Forschungsgruppe für Systemimmunologie
Die Max-Planck-Forschungsgruppe für Systemimmunologie ist eine gemeinsame Initiative der Julius-Maximilians-Universität Würzburg (JMU) und der Max-Planck-Gesellschaft (MPG) mit dem Ziel exzellente immunologische Forschung zu fördern. Die rund 50 internationalen Forschenden aus 24 Ländern wollen die Grundlagen für eine erfolgreiche Immunantwort gegen Infektionserreger, chronisch entzündliche Erkrankungen und Tumore verstehen, um neue Konzepte und Strategien für Impfstoffe und Immuntherapien zu entwickeln.
Dabei untersuchen sie die Entwicklung und Funktion des Immunsystems ganzheitlich auf mehreren Ebenen: von hochauflösenden Analysen einzelner Moleküle und Zellen, über komplexe zelluläre Netzwerke innerhalb von Organen, bis hin zu den systemischen Wechselwirkungen im Körper und mit der Umwelt. Diese Forschungsziele fügen sich hervorragend in das Umfeld der international sichtbaren Forschung zu Infektionskrankheiten und Immuntherapien auf dem Würzburger Life-Science-Campus ein.
Weitere Informationen: www.med.uni-wuerzburg.de/systemimmunologie/