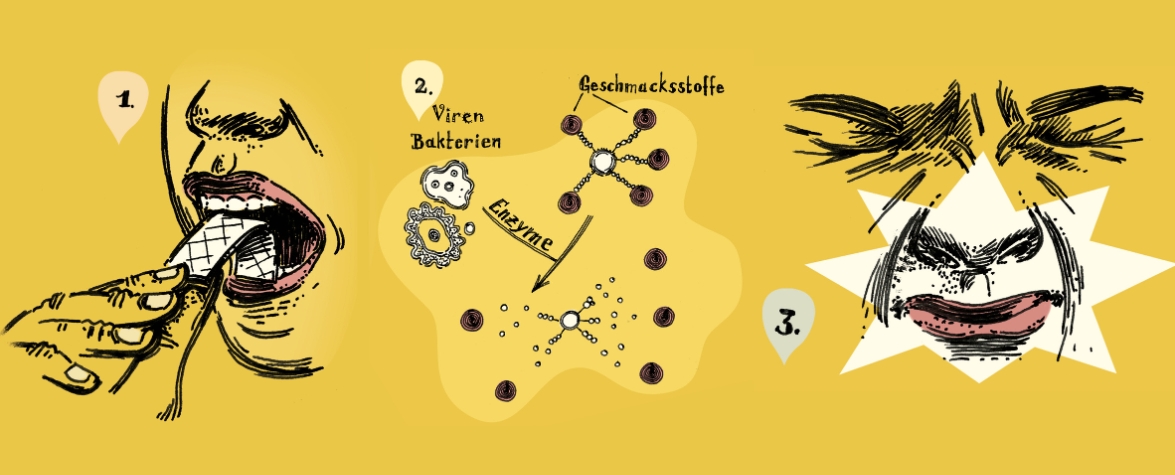
In der vom Bundesministerium für Forschung, Technologie und Raumfahrt geförderten Studie wird ein Konzept für einen geschmacksbasierten Nachweis von Influenza beschrieben.
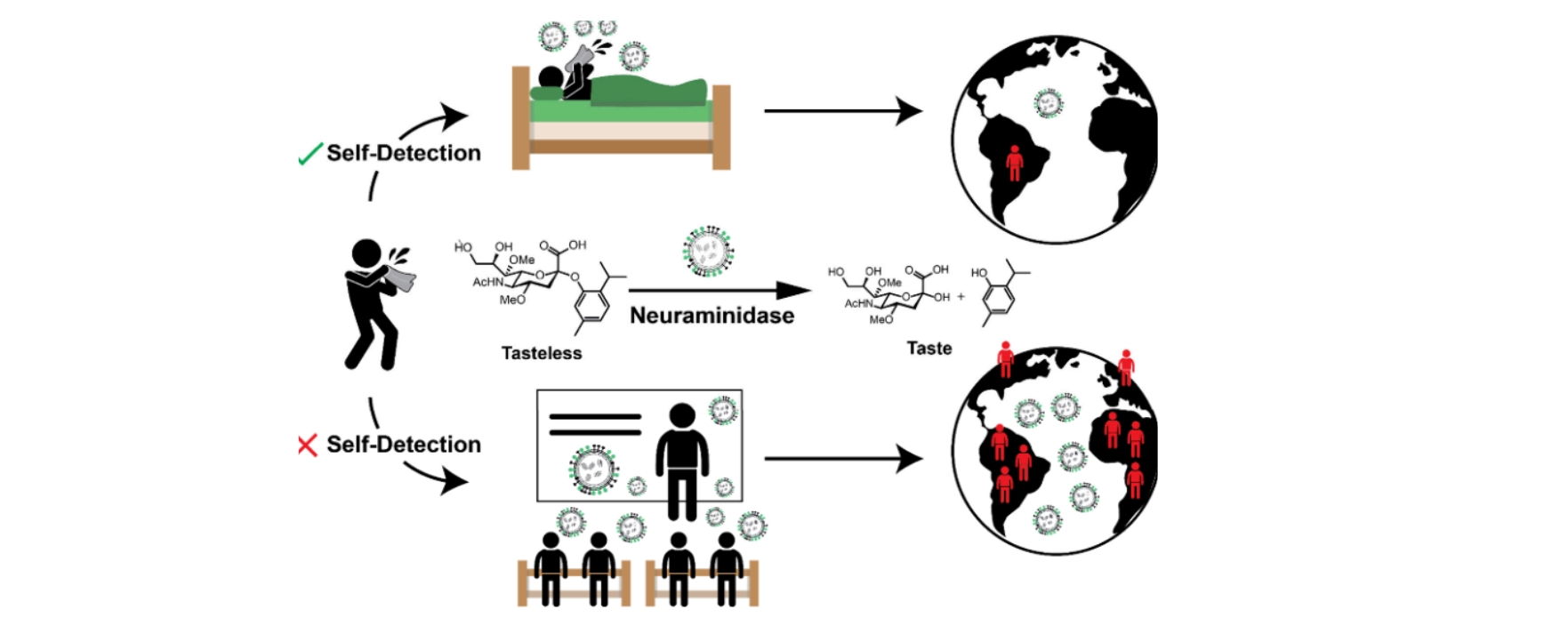
Ein Aromastoff (zum Beispiel Thymol) wird an eine leicht veränderte Zuckerverbindung (Sialinsäure) gebunden. Diese Verbindung ist so aufgebaut, dass sie den Aromastoff erst dann freisetzt, wenn das Enzym Neuraminidase des Grippevirus sie spaltet. Durch gezielte chemische Veränderungen, sogenannte O-Methylierungen, wird die Spaltung durch bakterielle Neuraminidasen reduziert. Kommt der Thymol-Zuckerbaustein also mit aktiven Grippeviren in Kontakt, setzen diese ihn frei und es entsteht ein klar erkennbarer Geschmack im Mund.
In Speichelproben aus zwei Grippesaisons wurden Neuraminidase-Aktivitäten gemessen, die eine Geschmacksfreisetzung in der Regel innerhalb von 10 bis 30 Minuten ermöglichten. Molekulare Modellierungen und die Hemmbarkeit durch Oseltamivir stützen die Adressierung des viralen Enzyms, d. h., das virale Enzym wird tatsächlich angesprochen.
Die Studie zeigt demnach, dass das Grundprinzip funktioniert. Wie zuverlässig, sicher und praktisch das Verfahren außerhalb des Labors ist, muss jedoch noch untersucht werden.
Das Prinzip ist übrigens flexibel: Sowohl der Geschmacksträger als auch der Erkennungsbaustein lassen sich anpassen. So kann das System beispielsweise mit süßen, bitteren oder salzigen Geschmacksrichtungen ausgestattet werden, was auch für Kinder geeignet ist. Ebenso lässt es sich auf unterschiedliche Krankheitserreger übertragen.
Somit eröffnet die Methode neue Möglichkeiten für die niederschwellige Diagnostik viraler und bakterieller Infektionen – von Influenza bis hin zu zukünftigen, heute noch unbekannten Erregern.
Zum Würzburger Beitrag: Das Institut für Organische Chemie der Universität Würzburg hat die Synthese des Sensormoleküls mitentwickelt. An der HNO-Klinik des Universitätsklinikums Würzburg (UKW) wurden die klinischen Proben gesammelt, der Gesundheitszustand der Patienten festgestellt und dokumentiert.
Zur Pressemeldung
Martina Raschig, Marcus Gutmann, Josef Kehrein, Eberhard Heller, Michael Bomblies, Marcel Groß, Oskar Steinlein, Peggy Riese, Stephanie Trittel, Tessa Lühmann, Carlos A. Guzmán, Jürgen Seibel, Heinrich Jehle, Christian Linz, Stephan Hackenberg, and Lorenz Meinel. A Viral Neuraminidase-Specific Sensor for Taste-Based Detection of Influenza. ACS Central Science Article ASAP. https://doi.org/10.1021/acscentsci.5c01179