Würzburg. Eine allogene Stammzelltransplantation, also die Transplantation von Stammzellen eines fremden Spenders, kann für Patienten, deren eigenes Knochenmark keine gesunden Blutzellen mehr bilden kann, lebensrettend sein. Doch die Therapie birgt auch Risiken: Bestimmte Immunzellen des Spenders, sogenannte T-Zellen, können den Körper des Empfängers als fremd erkennen und eine überschießende Abwehrreaktion auslösen. Diese gefährliche Komplikation wird als Graft-versus-Host-Disease (GvHD) bezeichnet, auf Deutsch auch Transplantat-gegen-Wirt-Reaktion.
Im Rahmen des von der Deutschen Forschungsgemeinschaft geförderten Sonderforschungsbereichs/Transregio SFB/TRR 221 untersuchen die Unikliniken Erlangen, Regensburg und Würzburg gemeinsam innovative Strategien zur Steuerung der Transplantat-gegen-Wirt-(GvHD)- und Transplantat-Leukämie-(GvL)-Effekte. Ziel ist es, die Sicherheit und Wirksamkeit der allogenen Stammzelltransplantation (allogene hämotopoetische Stammzelltransplantion, allo-HCT) zu verbessern. So wurde beispielsweise untersucht, warum die entzündlichen Spender-T-Zellen, die eine GvHD antreiben, vom Immunsystem, genauer gesagt von den Makrophagen, die auch als Fresszellen oder Reinigungskräfte bekannt sind, nicht wirksam entfernt werden. Dabei enthüllten die Forschenden einen versteckten Überlebenstrick der schädlichen Spender-T-Zellen.
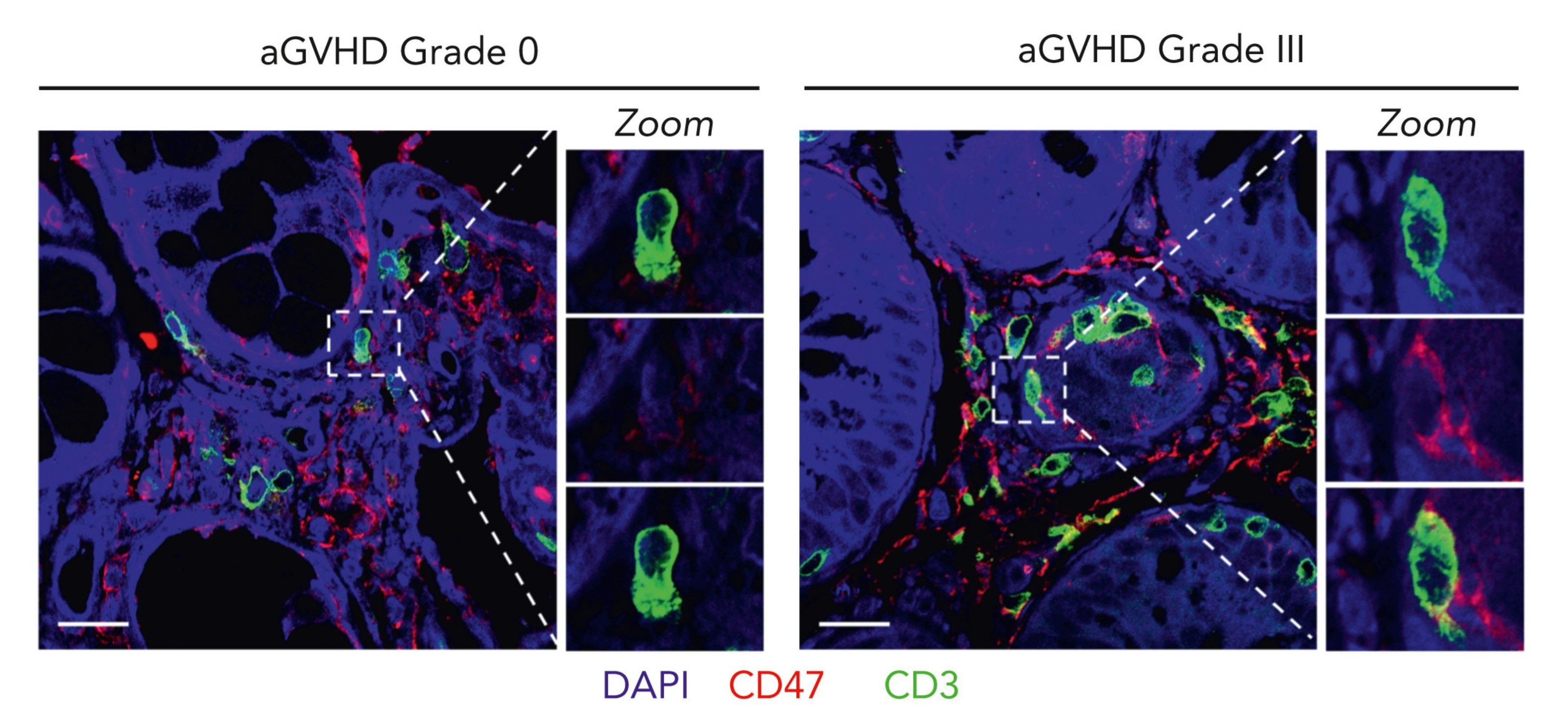
T-Zellen senden mit CD47 ein „Don’t eat me“-Signal an das Immunsystem
Die schädlichen Spender-T-Zellen exprimieren ungewöhnlich hohe Konzentrationen des Proteins CD47. Dabei handelt es sich um ein Oberflächenprotein, das den Makrophagen signalisiert: „Fresst mich nicht“. Diese Überexpression wurde sowohl bei Patientinnen und Patienten mit GvHD als auch in Mausmodellen beobachtet.
„Damit bringen wir CD47 erstmals eindeutig mit der Transplantat-gegen-Wirt-Reaktion in Verbindung“, sagt Dr. Haroon Shaikh von der Medizinischen Klinik und Poliklinik II des Uniklinikums Würzburg (UKW). Der Immunologe aus der Arbeitsgruppe von Prof. Dr. Andreas Beilhack publizierte die Ergebnisse in der renommierten Fachzeitschrift Blood. Die Erstautorenschaft teilt er sich mit Dr. Cindy Flamann aus der Gruppe von PD Dr. Heiko Bruns vom Uniklinikum Erlangen.
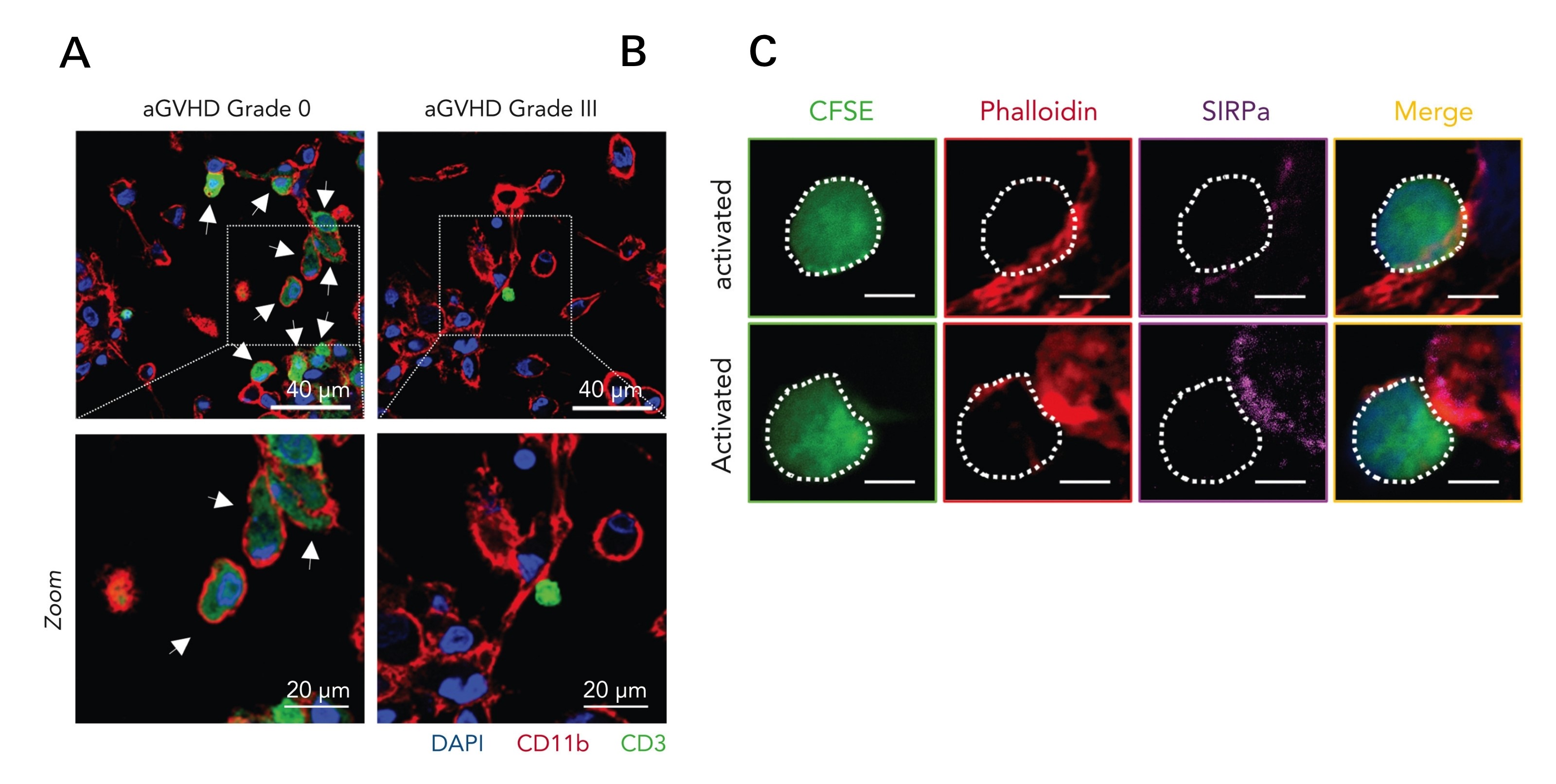
Blockierung des CD47-Signals hilft, schädliche Zellen zu entfernen, Entzündungen zu reduzieren und Überlebenschancen zu verbessern
„Spannend wurde es, als wir CD47 mit Antikörpern blockiert haben“, berichtet Haroon Shaikh. „Denn durch die Blockierung wurde die Fähigkeit der Makrophagen wiederhergestellt, die alloreaktiven T-Zellen zu phagozytieren und somit zu eliminieren. Bei unseren Mäusen konnten wir beobachten, dass die schädlichen Zellen effektiver beseitigt wurden, die Entzündung im Darm zurückging und sich ihre Überlebenschancen verbesserten. Darüber hinaus verursachten Spender-T-Zellen ohne CD47 deutlich weniger Transplantat-gegen-Wirt-Erkrankungen und führten zu besseren Ergebnissen.“
„Die Studie zeigt die besondere Stärke unserer Zusammenarbeit im SFB/TRR 221 GvH-GvL und ihren klar translationalen Anspruch“, betont Andreas Beilhack. „Unsere Ergebnisse eröffnen ein vielversprechendes klinisches Potenzial für die Blockade von CD47 zur Behandlung von GvHD“, unterstreicht Heiko Bruns. Auf dieser Basis bereitet das Team bereits erste klinische Studien vor.
Publikation:
Flamann C*, Shaikh H*, Matos C, Kreutz M, Ali H, Kern MAG, Büttner-Herold M, Jacobs B, Völkl S, Lischer C, Kellner C, Berges J, Bitterer K, Saul D, Goel M, Link-Rachner CS, Zernecke A, Weber D, Mougiakakos D, Mackensen A, Beilhack A, Bruns H. Augmented CD47 expression impairs alloreactive T-cell clearance after allo-HCT. Blood. 2025 Sep 11;146(11):1359-1373. doi: 10.1182/blood.2023023056. PMID: 40332470.