Flight, fight or freeze. Wegrennen, sich wehren oder vor Angst erstarren. Jeder reagiert anders auf eine Bedrohung. Das Verhalten hängt ganz davon ab, welche neuronalen Schaltkreise in unserem Gehirn aktiviert werden, um uns vor möglichen Schäden zu schützen. Das Defense Circuits Lab am Universitätsklinikum Würzburg beschäftigt sich vor allem mit dem Angstzustand. Wie verhalten wir uns, wenn wir Angst empfinden? Wie reagiert unser Körper darauf? Und wie hängen Emotion und physiologische Reaktion zusammen?
Rahmenkonzept für präzise Charakterisierung von Angstzuständen
„Obwohl die Neurowissenschaft schon länger an der Entschlüsselung von Angstzuständen und entsprechenden Behandlungsansätzen arbeitet, ist es noch nicht gelungen, ein einheitliches Bild zu gewinnen, das sowohl Verhaltensänderungen als auch physiologische Reaktionen und deren dynamisches Zusammenspiel während Angstzuständen beschreibt“, berichtet Prof. Dr. Philip Tovote, Leiter des Defense Circuits Lab und Kodirektor des Instituts für Klinische Neurobiologie. Eine Angstreaktion werde immer noch auf eine Verhaltensänderung reduziert wie etwa auf die Schockstarre, bei der die Bewegungen förmlich einfrieren, im Englischen freezing genannt. Die Änderung der Herzrate jedoch wurde nie als eine verlässliche Komponente zur Charakterisierung von Angstzuständen wahrgenommen, da die bisherige Studienlage keine einheitlichen Ergebnisse hervorbrachte.
„Um Angst und die damit verbundenen oft übermäßig stark ausgeprägten körperlichen Reaktionen zu behandeln, ist es wichtig, das genaue Zusammenspiel von Körper und Gehirn besser zu verstehen. Angststörungen gehören zu den häufigsten psychiatrischen Erkrankungen und treten oftmals im Zusammenhang mit kardiovaskulären und neurodegenerativen Erkrankungen wie etwa Parkinson oder Herzinsuffizienz auf“, erinnert Philip Tovote.
In der Tat hat auch Tovotes Team im Institut für klinische Neurobiologie bei Mäusen mit identischem Angstverhalten grundsätzlich verschiedene Herzraten beobachtet - mal waren sie erhöht, mal erniedrigt, mal unverändert. Diese zunächst scheinbar widersprüchlichen kardialen Reaktionen haben die Wissenschaftlerinnen und Wissenschaftler nun in einem Rahmenkonzept zusammengefasst, welches die Einflüsse übergeordneter Zustände, sogenannter „Macrostates“ beschreibt und damit die unterschiedlichen Herzaktivitäten erklärbar macht.
Gehirnnetzwerke, die für Angstzustände wichtig sind, besser verstehen
„Mit unserer Analyse ist es uns jetzt möglich, feine Abstufungen von verschiedenen Verhaltensänderungen, die zunächst gleich aussehen, aufgrund ihrer unterschiedlichen begleitenden Herzantworten zu erkennen“, freut sich Jérémy Signoret-Genest. Der Biologe ist gemeinsam mit Nina Schukraft Erstautor der Studie „Integrated cardio-behavioural responses to threat define defensive states“, die jetzt im Fachmagazin Nature Neuroscience publiziert wurde. Letztendlich könne diese präzise Charakterisierung von verschiedenen Ausprägungen von Angstzuständen dazu beitragen, Gehirnnetzwerke, die für die Entstehung von Angstzuständen wichtig sind, besser zu verstehen.
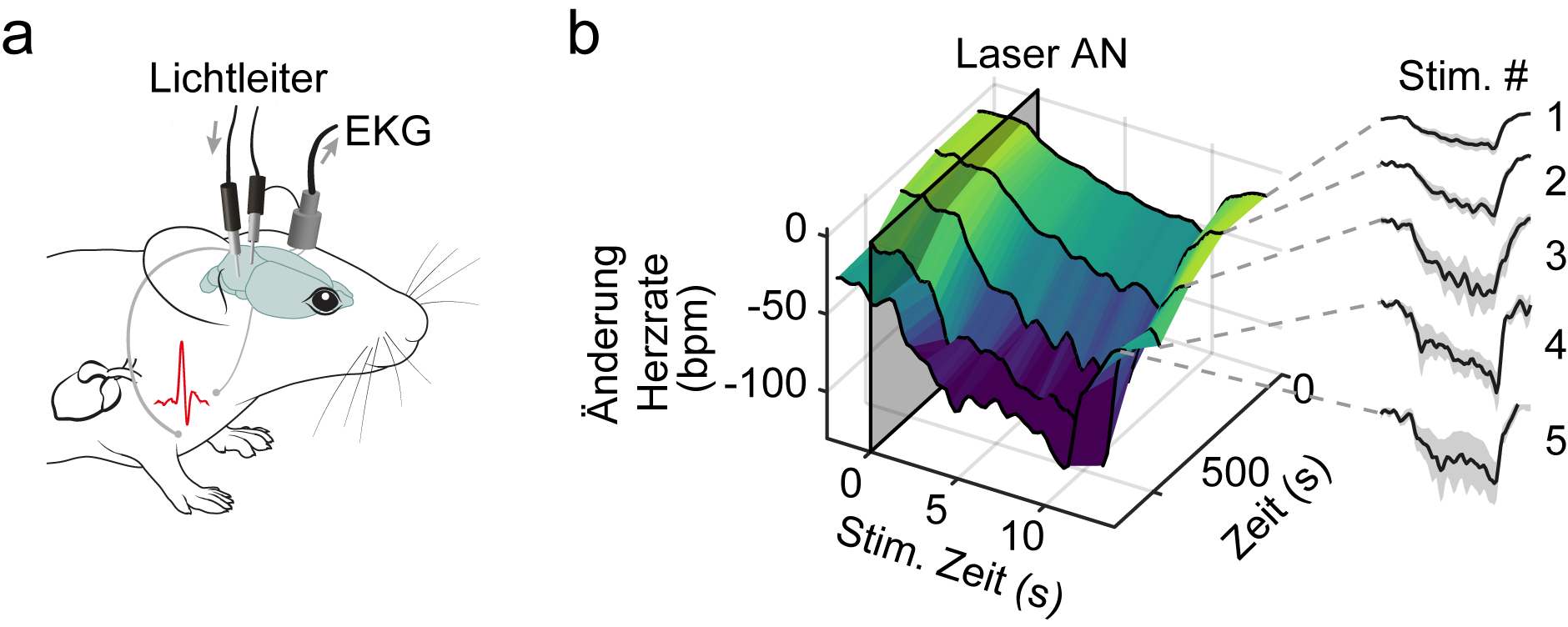
„Wir konnten bestimmte Nervenzellen im Mittelhirn identifizieren, die für die Generierung einer typischen Angstreaktion in Mäusen verantwortlich sind“, erläutert Nina Schukraft die Entdeckung. Dafür wurden neueste neurowissenschaftliche Methoden genutzt, die es erlauben mittels Licht die Aktivität ausgewählter Nervenzellen zu kontrollieren. Die genetischen Konstrukte für diese so genannten optogenetischen Versuche wurden dem Würzburger Team von einem Begründer der Optogenetik, Karl Deisseroth von der Stanford University (USA) zur Verfügung gestellt,
Pathologische Angstzustände genauer erkennen und gezielter behandeln
Um das Rahmenkonzept auszuweiten und unterschiedliche Angstzustände voneinander abzugrenzen sollen in Zukunft weitere Parameter wie zum Beispiel Atemfrequenz und Temperatur in die Analyse aufgenommen werden. Die umfangreichen und komplexen Daten sollen mittels „unbiased clustering“-Ansätzen in Cluster mit ähnlichen Eigenschaften zusammengeführt werden. Und schließlich soll das Konzept der durch viele verschiedene Faktoren mit unterschiedlicher zeitlicher Ausprägung bedingten „States“ auch auf krankheitsrelevante Zustände, so genannte „Pathostates“ übertragen werden. Damit würde ein besseres Verständnis der mit Angststörungen verbundenen Erkrankungen und ihrer zeitlichen Dynamik einhergehen, welches neue und verbesserte Therapieansätze zulasse. „Eine durch unser Rahmenwerk integrierte Analyse der verschiedenen, dynamischen Angstreaktionen und deren Abhängigkeit voneinander, könnte dazu beitragen, pathologische Angstzustände genauer und individuell angepasst zu erkennen und letztendlich besser zu behandeln“, resümiert Philip Tovote. Er ist zuversichtlich: „Unsere enge Verzahnung mit der klinischen Forschung im Rahmen großer Verbundprojekte auf dem Feld der Neurologie und Psychiatrie ermöglicht uns die Umsetzung dieser Ziele.“
Förderungen
Diese Forschung im Defense Circuits Lab wurde maßgeblich von der Deutschen Forschungsgemeinschaft unterstützt, die eine Heisenberg-Professur und entsprechende Projektförderung für Philip Tovote finanziert (TO 1124/1,2,3]). Die Arbeiten zu den neuronalen Grundlagen der Schockstarre werden weiterhin von der DFG im Rahmen des Transregio-Sonderforschungsbereichs „Retune“, der sich mit den Mechanismen der Tiefenhirnstimulation beschäftigt, gefördert (TRR 295: [446022135], [446270539]). Des Weiteren unterstützt die Europäische Union im Rahmen des „Horizon 2020 research and innovation programme“ (Marie Skłodowska-Curie grant 956414), sowie die Brain and Behavior Foundation (Newe York, USA) die Arbeiten des Defense Ciruits Lab am Universitätsklinikum Würzburg. Sara L. Reis wurde mit einem Stipendium der Fundação para a Ciência e a Tecnologia aus Portugal gefördert.
Publikation:
Signoret-Genest, J., Schukraft, N., L. Reis, S. et al. Integrated cardio-behavioral responses to threat define defensive states. Nat Neurosci 26, 447–457 (2023). doi.org/10.1038/s41593-022-01252-w