Würzburg. Chronische Wunden stellen in Deutschland eine immer bedeutendere gesundheitliche Herausforderung dar. Schätzungen zufolge leiden schon jetzt ein bis zwei Millionen Menschen an Wunden mit verzögertem oder ausbleibendem Heilungsverlauf. Überwiegend betroffen sind ältere und multimorbide Personen. Aufgrund des demografischen Wandels und einer alternden Bevölkerung ist von einer weiter steigenden Inzidenz auszugehen. Faktoren wie Diabetes, Durchblutungsstörungen oder Druckbelastungen verhindern häufig eine normale Heilungskaskade, sodass die Wunde in einem dauerhaften Entzündungs- oder Reparaturstadium steckenbleibt. Auch Bakterien können die Wundheilung verzögern.
Pseudomonas aeruginosa: Biofilm-Bildung als Hindernis für die Wundheilung
Besonders problematisch ist der Keim Pseudomonas aeruginosa, da er die Fähigkeit zur Biofilmbildung besitzt und dadurch die Heilung chronischer Wunden deutlich verzögert. Der Biofilm wirkt wie eine Schutzbarriere und verhindert, dass die Keime weder von Immunzellen noch Antibiotika oder Antiseptika erreicht und vernichtet werden. Zudem setzt Pseudomonas aeruginosa im Biofilm kontinuierlich entzündungsfördernde Substanzen und Toxine frei, wodurch die Wunde in einer persistierenden Entzündungsphase gehalten wird. Last but not least werden durch das stäbchenförmige Bakterium Enzyme und Proteasen produziert, durch die Gewebe abgebaut und wichtige Zellen der Wundheilung geschädigt werden.
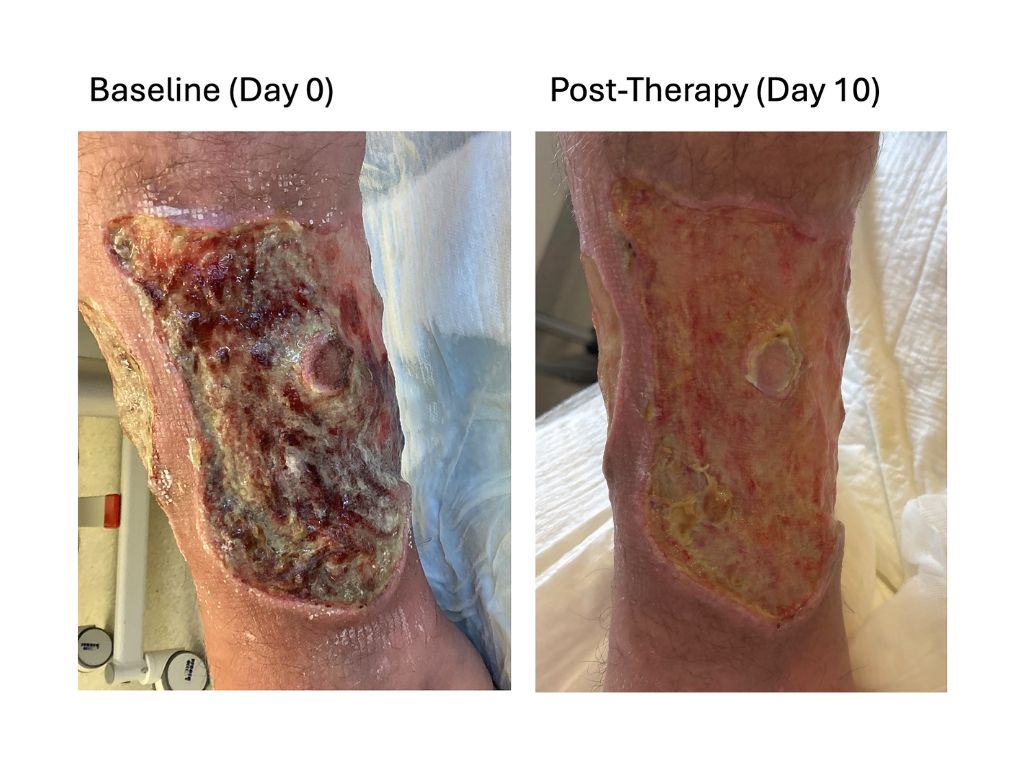
Nach ein bis zwei Wochen zeigte sich neues, gesundes Gewebe
Ein Team der Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie des Universitätsklinikums Würzburg (UKW) hat nun einen vielversprechenden Ansatz gefunden, um diesen widerstandsfähigen Keim zu bekämpfen. Dieser wurde als klinischer Tipp im Journal of the American Academy of Dermatology veröffentlicht. Die Forschenden behandelten zwei ältere Patienten mit lang bestehenden, infizierten Wunden zusätzlich zur Standardversorgung mit einem Lactobacillus-haltigen Pulver. Das probiotische Präparat enthält „gute” Milchsäurebakterien, wie sie auch im Körper vorkommen. Bereits nach wenigen Tagen verbesserten sich Geruch und Belag der Wunden deutlich und nach ein bis zwei Wochen zeigte sich neues, gesundes Gewebe. In den anschließenden Kontrollabstrichen war Pseudomonas aeruginosa nicht mehr nachweisbar. Die Behandlung wurde gut vertragen und es traten keine relevanten Nebenwirkungen auf. Ähnliche Verbesserungen zeigten sich auch bei weiteren Patientinnen und Patienten.
Milchsäurebakterien fördern die Wundheilung und tragen zur Beseitigung von Pseudomonas aeruginosa bei, ohne Resistenzen zu begünstigen
„Milchsäurebakterien können demnach schädliche Bakterien wie Pseudomonas aeruginosa schwächen, indem sie deren Biofilme stören, Entzündungen reduzieren und die Zellen der Wundheilung aktivieren“, deutet Dr. Tassilo Dege, Erstautor der Fallbeobachtung, die Ergebnisse.
Untersuchungen an Modellen mit menschlicher Haut bestätigten, dass Lactobazillen den Biofilm der Pseudomonas-Bakterien schwächen und ihre Kommunikation stören. Dadurch werden die problematischen Bakterien weniger schädlich. Gleichzeitig regen bestimmte Signale, wie Interleukin-6, wichtige Hautzellen (Keratinozyten) und Bindegewebszellen (Fibroblasten) an, sodass die Wundheilung unterstützt wird. In Tiermodellen mit Mäusen konnte zudem beobachtet werden, dass bestimmte Stoffwechselprodukte der Lactobazillen (postbiotische Metaboliten) die Anzahl der Pseudomonas-Bakterien sowie die Entzündung in der Wunde reduzierten.
„Unsere Ergebnisse legen nahe, dass Probiotika eine einfache und gut verträgliche Ergänzung zur Behandlung chronischer Wunden darstellen könnten, ohne das Risiko von Antibiotikaresistenzen mit sich zu bringen“, so Prof. Dr. Astrid Schmieder. Gleichzeitig warnt sie jedoch, dass lebende Probiotika theoretisch Risiken bergen und eine sorgfältige ärztliche Überwachung daher notwendig ist. Weitere Studien sollen diesen einfachen und sicheren ergänzenden Therapieansatz nun genauer untersuchen.
Krankheitsbilder und Behandlung der beiden Patienten
In der dermatologischen Fallbeobachtung litt ein Patient unter einem so genannten Pyoderma gangraenosum, der andere unter einem venösen Beingeschwür. Beide Wunden waren mit dem Bakterium Pseudomonas aeruginosa besiedelt. Nach der täglichen Wundreinigung mit steriler Kochsalzlösung (NaCl) wurde die Wunde mit einer nicht haftenden Wundauflage (Adaptic) abgedeckt, plus mehrschichtiger Kompression im Fall des venösen Beingeschwürs. Zusätzlich wurde die Wunde täglich mit einem Präparat mit Milchsäurebakterien (Vagisan mit Lactobacillus gasseri und Lacticaseibacillus rhamnosus in hoher Keimzahl) behandelt.
Publikation:
Tassilo Dege, Andreas Kerstan, Matthias Goebeler, Astrid Schmieder. Clinical pearl: Topical Lactobacillus application to disrupt Pseudomonas aeruginosa biofilms and promote healing in chronic wounds, Journal of the American Academy of Dermatology, 2025, ISSN 0190-9622, https://doi.org/10.1016/j.jaad.2025.12.071.