Würzburg. In der Wirtschaft, im Marketing und im sozialen Bereich werden gerne finanzielle Anreize, sogenannte Incentives, eingesetzt, um die Motivation von Menschen zu steigern, ihr Verhalten zu lenken und nachhaltige Erfolge zu erzielen. Letzteres ist jedoch nicht immer der Fall, wie eine aktuelle Studie (Royal Society Open Science) des Universitätsklinikums Würzburg (UKW) zeigt. Prof. Dr. Grit Hein und ihr Team der Translationalen Sozialen Neurowissenschaften am Zentrum für Psychische Gesundheit (ZEP) untersuchten, ob sich Menschen aus einer bestimmten Gruppe einer fremden Gruppe annähern, wenn sie dafür Geld erhalten. Tatsächlich veränderten Belohnungen und Bestrafungen in den Untersuchungen das Verhalten, aber nicht die Einstellung. Grundsätzliche Vorurteile gegenüber der Fremdgruppe blieben bestehen. Das heißt: Belohnungssysteme können Türen öffnen und den ersten Schritt in Richtung Kontakt ermöglichen. Um aber tief verwurzelte Vorurteile abzubauen und Einstellungen nachhaltig zu verändern, sind zusätzliche Strategien erforderlich, wie etwa gemeinsame Erfahrungen, Dialog oder langfristige Begegnungen zwischen den Gruppen.
Die Studie fand im Rahmen des von der Deutschen Forschungsgemeinschaft geförderten Graduiertenkollegs GRK 2660 - Research Training Group 2660: Approach-Avoidance statt. „Hier geht es um die spannenden Fragen, warum und wie wir uns bestimmten Reizen oder Personen nähern oder sie meiden, und was passiert, wenn ein Konflikt entsteht“, sagt Jasper Bischofberger, Erstautor der Studie. „Annäherungs- und Vermeidungsverhalten können wir ganz grundlegend in Tierversuchen untersuchen mit Belohnungen und Strafreizen, aber auch bei Menschen in sozialen Kontexten.“
Priming: Typische Eigenschaften der In- und Out-Group und Zuordnung von abstrakten Symbolen
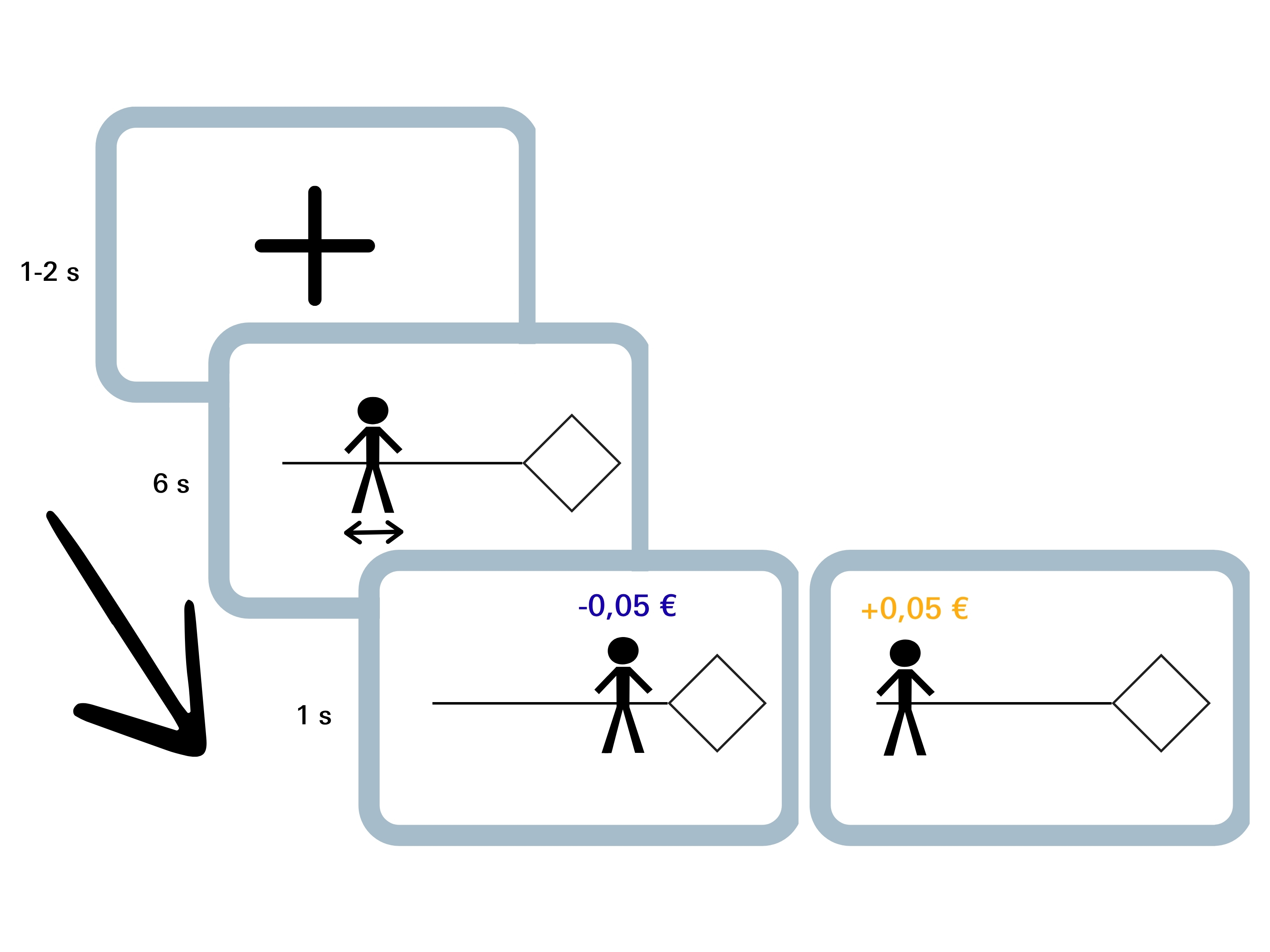
Für das sogenannte Priming in der Lernstudie sollten die Probandinnen und Probanden mit deutscher Staatsangehörigkeit zunächst fünf Adjektive aufschreiben, die sie mit einer Person der eigenen Nationalität, also der eigenen sozialen In-Group, verbinden. Außerdem sollten sie fünf typische Eigenschaften nennen, die ihnen zu einer Person mit chinesischer Staatsangehörigkeit einfallen. Das war die Out-Group. Anschließend wurden Eindrucksskalen bearbeitet sowie zwei abstrakte, geometrische Symbole – eine Raute und ein Sechseck – der In- und Out-Group zugeordnet. „Die Symbole hatten weder eine Bedeutung noch eine Wertigkeit, sodass spezifische Assoziationen mit diesen Symbolen kontrolliert induziert werden konnten“, so Bischofberger. Im Hauptteil des Lernexperiments sahen die Teilnehmenden auf einem Monitor eine Spielfigur, die sie selbst repräsentierte. Mithilfe eines Cursors konnten sie die Person auf einer horizontalen Linie zwischen der Raute und dem Sechseck hin und her bewegen. Die meisten zog es am Anfang zu ihrer eigenen Gruppe.
Lernerfahrung verändert Vermeidungs- und Annäherungs-Bias
„Hier zeigte sich ganz klar der sogenannte Bias. Die Menschen gehen lieber auf ihre eigenen Leute zu und bevorzugen Personen, die zu ihrer eigenen Gruppe gehören“, erläutert Grit Hein. Um zu prüfen, ob sich dieses Annäherungs-Vermeidungs-Verhalten durch finanzielle Anreize verändert, erhielten die Probandinnen und Probanden mit unterschiedlicher Wahrscheinlichkeit einen kleinen Geldgewinn, wenn sie sich der Figur näherten, welche die fremde Gruppe symbolisierte. Sobald sie sich wieder dem Symbol der eigenen Gruppe annäherten, wurde ihnen Geld abgezogen. „Wir haben sie gewissermaßen bestochen“, sagt Grit Hein. „Es waren zwar nur minimale Beträge, 5 Cent, aber wir wissen aus anderen Studien, dass das sehr gut funktioniert.“ Allerdings wussten die Studienteilnehmenden anfangs nichts von dem finanziellen Anreiz. Sie mussten zunächst erlernen, welches Verhalten ihnen den größten Profit einbrachte.
„Selbst in so einer artifiziellen Studie ist der Bias extrem stark“
Tatsächlich veränderten die Studienteilnehmenden im Laufe der Lernstudie ihr Verhalten in Abhängigkeit von diesen finanziellen Belohnungen und Bestrafungen. Wurde das Annähern an die andere Gruppe belohnt, verringerte sich die Vermeidungstendenz spürbar. Bestrafungen waren dabei weniger wirksam als Belohnungen. Kontrollstudien, in denen die Symbole keine soziale Bedeutung hatten, zeigten diese Effekte so nicht. Das heißt: Vorurteile im Verhalten bauten sich nur ab, wenn die Symbole sozial aufgeladen waren und Gruppenmitgliedschaften repräsentierten.
Obwohl die Teilnehmenden im Laufe der Lernstudie ihr Verhalten anpassten, blieben ihre persönlichen Eindrücke und Einstellungen gegenüber der Fremdgruppe nach der Lernaufgabe stabil. „Die Studie verdeutlicht klar die Limitation finanzieller Anreize: Es geht nicht über das bloße Hingehen hinaus, die Meinung ändert sich nicht. Selbst in so einer artifiziellen Studie ist der Bias extrem stark“, bemerkt Grit Hein.
Das Wort „Bias“ bezeichnet eine systematische Verzerrung oder Neigung, die das neutrale Urteil, Verhalten oder Ergebnis beeinflusst. In der Wissenschaft und Technik steht Bias für einen Fehler, im sozialen Kontext für Voreingenommenheit. Menschen können Bias sowohl für als auch gegen eine einzelne Person, eine Gruppe oder eine Überzeugung entwickeln. Ein großes und nach wie vor aktuelles Thema ist der Gender Bias. Die dadurch entstehenden systematischen Verzerrungen beeinflussen Wahrnehmungen und Entscheidungen in vielen Bereichen und können zu Benachteiligungen, beispielsweise bei Karrierechancen oder in der medizinischen Versorgung, führen.
Social Prediction Errors: Soziales Lernen entsteht, wenn Erwartungen und Vorhersagen gebrochen werden
Boni oder finanzielle Anreize für das Einbeziehen unterrepräsentierter Personengruppen können ein erster Schritt sein, der Kontakt herstellt, was aber nicht bedeutet, dass diese Personen gleichwertig behandelt werden. Um dies zu erreichen, müssen andere Formen von Lernen folgen.
In einer kulturvergleichenden Studie, die demnächst publiziert wird (Zhou u.a., in press), konnte Grit Hein zum Beispiel gemeinsam mit einem internationalen Team zeigen, dass Voreingenommenheit gegenüber Fremden bei deutschen und chinesischen Probandinnen und Probanden „überlernt” werden kann, wenn nämlich die westlichen und ostasiatischen Teilnehmerinnen und Teilnehmer von negativen Erfahrungen mit der eigenen Gruppe lernen. Man hatte etwas Positives von der eigenen Gruppe erwartet, bekam aber das Gegenteil. Die Erwartung wurde enttäuscht, was die Einstellung gegenüber der fremden Gruppe verbesserte. Ostasiatische Probanden änderten ihre Einstellung gegenüber ihrer eigenen Gruppe nur, wenn sie sich nicht so stark mit ihrer eigenen Gruppe identifizierten.
Zurück zum Belohnungssystem, das auch häufig in der Erziehung angewendet wird. Ein Beispiel: Wenn du deine Hausaufgaben erledigst, bekommst du ein Eis. Die Aufgaben werden vielleicht erledigt, aber nicht die Einstellung dazu. „Es wäre nachhaltiger, wenn das Kind selbst spürt, wie es an den Hausaufgaben wächst, und zum Beispiel rückwirkend positives soziales Feedback in der Schule erhält“, so Hein.
Gemeinsame Interessen können helfen Barrieren abzubauen
Die Psychologin schlägt den Bogen zurück zur Studie: „Um sich anzunähern und Begegnungen zu schaffen, braucht es vielleicht Anreize, aber um Vorurteile abzubauen, braucht es mehr. Wir müssen soziale Lernerfahrungen ermöglichen, etablieren und versuchen, das Bild des anderen zu überzeichnen.“ Die Adjektive, welche die Studienteilnehmer anfangs notiert hatten, sind in der Regel keine persönlichen Erfahrungen, sondern überlieferte Vorurteile. Um Barrieren zwischen Gruppen unterschiedlicher Nationen abzubauen, schlägt Grit Hein vor, über das Annähern hinaus Kontakt aufzunehmen und nach Ähnlichkeiten zu suchen, zum Beispiel nach gemeinsamen Interessen wie Sport, Kochen, Handwerk oder berufliche Ziele und Interessen. Reine finanzielle Anreize könnten auch nach hinten losgehen, mahnt die Wissenschaftlerin. Wenn Menschen das Gefühl haben, dass sie gekauft werden sollen um anders zu denken oder sich anders zu verhalten, kann das Vorurteile sogar verstärken, besonders wenn die finanziellen Anreize öffentlich gemacht werden.
Publikationen:
Bischofberger Jasper Amadeus, Saulin Anne, Zhou Yuqing and Hein Grit. 2025 Learning from financial rewards and punishments reduces the in-group bias in social approach without changing the in-group bias in impressions. R. Soc. Open Sci. 12:250061. https://doi.org/10.1098/rsos.250061
Zhou, Y., Lindström, B., Soutschek, A., Kang, P., Han, S., Tobler, P.N., Hein, G. (in press). Learning reduces Ingroup Bias More with Perceived Losses than Gains Across Cultures. npj Science of Learning.
Text: KL / Wissenschaftskommunikation