Forschende des Uniklinikums Würzburg zeigen in einer multizentrischen Studie, wie sich Resistenzmechanismen beim hepta-refraktären Multiplen Myelom mithilfe der Gesamtgenomsequenzierung entschlüsseln lassen. Die in der Fachzeitschrift Leukemia veröffentlichte Studie belegt: Sind Zielantigene wie BCMA oder GPRC5D noch vorhanden, kann eine erneute Immuntherapie wirksam sein – ein wichtiger Schritt hin zu präziserer Therapieentscheidung selbst nach sieben Vortherapien.
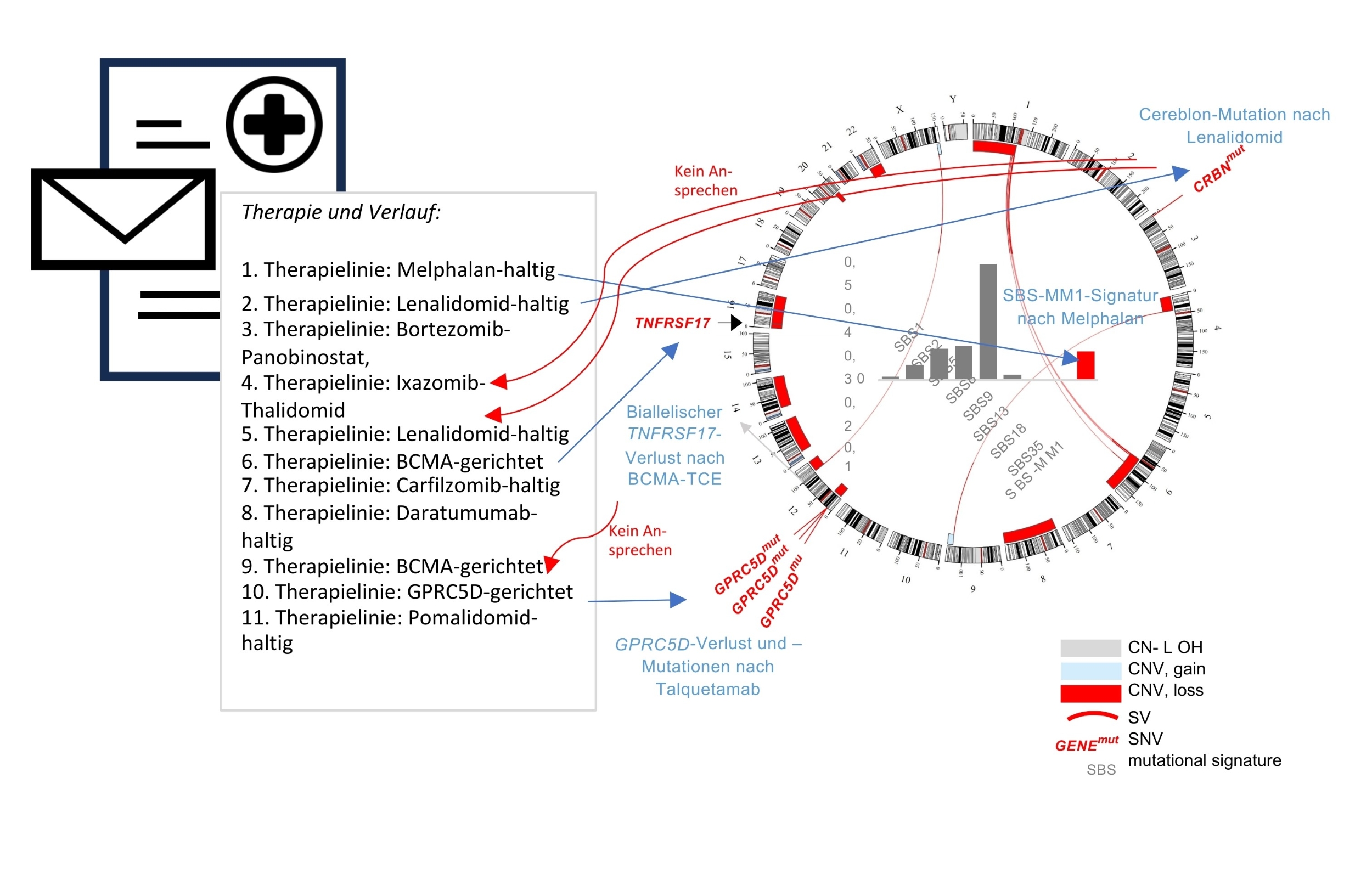
Würzburg. Was wie ein frustrierender Behandlungsmarathon klingt, ist laut Prof. Dr. Leo Rasche vom Myelomzentrum des Uniklinikums Würzburg (UKW) eine echte Erfolgsgeschichte. Denn früher gab es kaum wirksame Therapien für das Multiple Myelom. Heute sitzen Patientinnen und Patienten vor einem, die sieben verschiedene Medikamentenklassen erhalten haben: Je zwei Proteasom-Inhibitoren und Immunmodulatoren, monoklonale und bispezifische Antikörper sowie eine CAR-T-Zelltherapie. „Das heißt, sie haben schon viele Jahre mit der Erkrankung gelebt und sind dank der schonenderen, neuartigen Immuntherapien relativ fit“, sagt Rasche. Doch was ist zu tun, wenn der Patient nach der siebten Therapie ein Rezidiv hat, der Krebs zurückgekehrt ist und therapeutisch am Ende der Fahnenstange angelangt ist? Leo Rasche und sein Team in der Medizinischen Klinik II des UKW haben den Begriff hepta-refraktär eingeführt, also resistent gegen sieben (griech. hepta) wichtige Behandlungsarten.
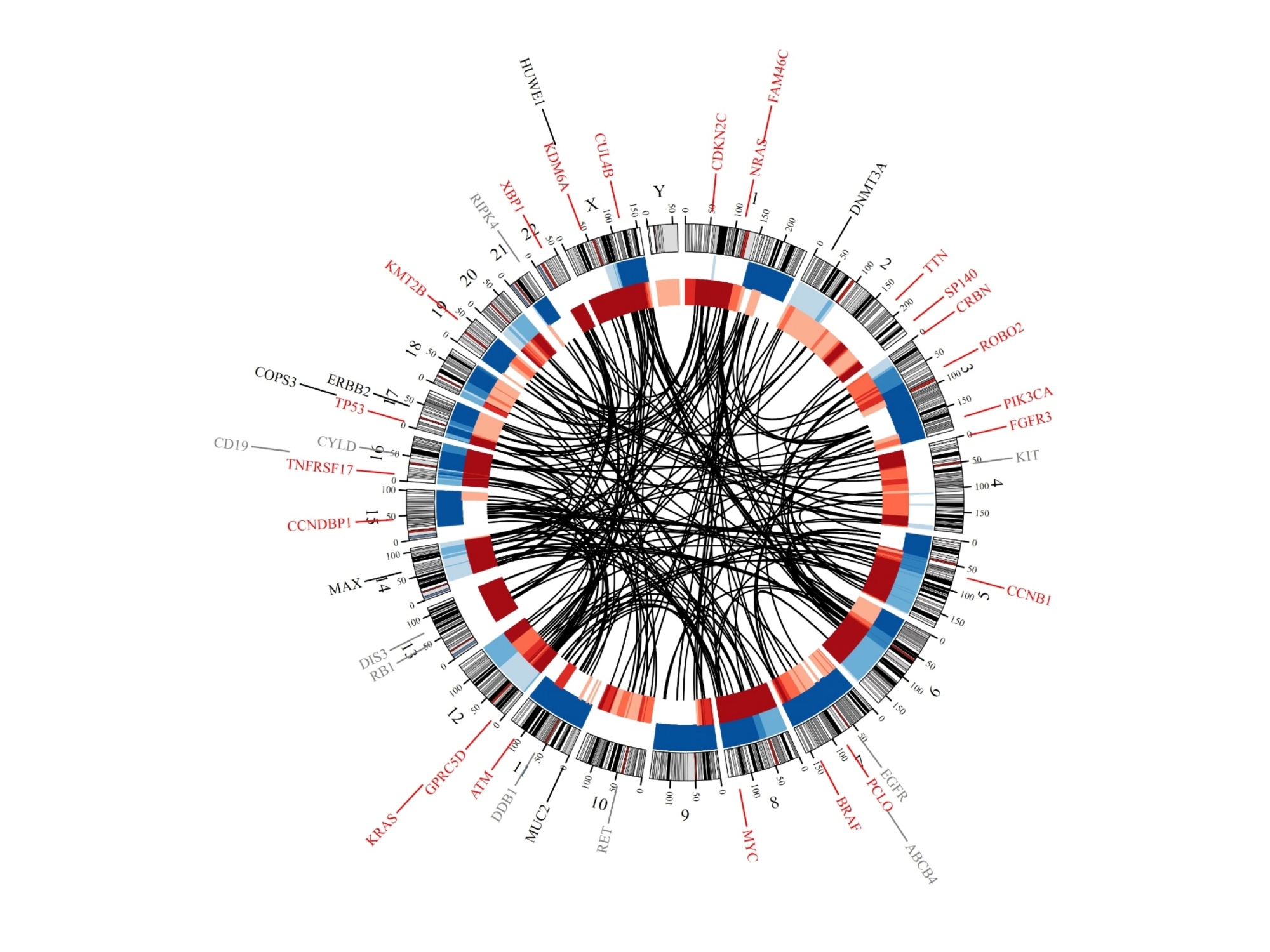
Rasche forscht bereits seit Langem an den Resistenzmechanismen, die solche Rückfälle antreiben. Das Verständnis dieser Mechanismen ist entscheidend für die Entwicklung geeigneter Behandlungsstrategien. „Wichtig ist jedoch, unsere Erkenntnisse aus dem Elfenbeinturm auf die Straße zu bringen. Das ist uns jetzt mit unserer neuesten Studie gelungen, in der wir Whole-Genome-Sequencing mit Immunhistochemie kombiniert haben“, freut sich Leo Rasche.
Myelom-Therapien hinterlassen Spuren im Genom
Gemeinsam mit Dr. Christine Riedhammer und Partnerinnen und Partnern aus Würzburg, München, Hamburg, Heidelberg und dem kanadischen Calgary konnte er zeigen, dass zahlreiche Therapien des Multiplen Myeloms Spuren im Genom der Tumorzellen hinterlassen. Mithilfe der Gesamtgenomsequenzierung ließen sich komplexe Vortherapien rekonstruieren – man könnte es einen genomischen Arztbrief nennen. „Tatsächlich können wir für einige Therapien ganz klar sagen, dass man diese nicht noch einmal einsetzen muss. Der Tumor ist definitiv resistent dagegen. Bei anderen konnten wir jedoch noch Angriffspunkte für eine erneute Therapie entdecken, sodass eine Wiederholung durchaus Sinn macht“, berichtet Christine Riedhammer. Die Hämatoonkologin teilt sich mit Marietta Truger die Erstautorenschaft der in der nature-Fachzeitschrift Leukemia veröffentlichten Erkenntnisse.
Insgesamt wurden 37 Patientinnen und Patienten, bei denen alle verfügbaren Therapien ausgeschöpft waren, in die multizentrische Studie aufgenommen. Bei 17 von ihnen führte das Münchner Leukämielabor (MLL) eine Ganzgenomsequenzierung durch.
Antigenverlust und Mutation bei der Hälfte der Patienten
Die Ergebnisse zeigen, dass bei etwa der Hälfte der Patientinnen und Patienten die Tumorzellen selbst die Resistenz verursachen. Das bedeutet, dass der Tumor durch Mutationen dafür gesorgt hat, dass die Immuntherapie nicht mehr wirkt. In diesem Fall spricht man von tumorintrinsischer Resistenzentwicklung. Bei der anderen Hälfte sind die Mechanismen hingegen noch völlig ungeklärt. Möglicherweise liegen diese in der Epigentik, im Immunsystem oder in der Mikroumgebung, also den gesunden Zellen in der Umgebung des Tumors. An dieser Stelle gibt es noch viel zu entdecken.
Sind Zielantigene BCMA oder GPRC5D auf den Myelomzellen noch intakt, kann die Immuntherapie ein zweites Mal gegeben werden
Was bedeuten diese Erkenntnisse für die weitere Behandlung? Sind die Schlüsselantigene für die Immuntherapie noch intakt, kann diese ein zweites Mal gegeben werden. Das Protein BCMA ist der Angriffspunkt für CAR-T-Zellen und GPRC5D für einen bispezifischen Antikörper. „In unserer Kohorte am UKW haben alle Patientinnen und Patienten mit vorhandenen Antigenen auf die erneute Immuntherapie angesprochen und waren im Median neun Monate in Remission“, berichtet Christine Riedhammer. Bei der Therapie des Multiplen Myeloms gehe es letztendlich in erster Linie noch um eine Lebensverlängerung bei guter Lebensqualität.
Letztendlich veranschaulicht die Studie, wie dringend neue Therapien und genaue diagnostische Untersuchungen sind. Denn sie verdeutlicht noch einmal die genetische Komplexität des Multiplen Myeloms sowie die Tumor-Evolution. Jede Therapie, die die Tumorzelle überlebt, macht sie stärker. Die Tumorzelle kann immer leichter überleben und sich teilen, da sie die Tumorsuppressor-Gene sukzessive ausschaltet. Diese Gene sorgen normalerweise dafür, dass kein Tumor entsteht. „Dadurch wird die Biologie immer wilder und die Zellen immer entfesselter“, schildert Leo Rasche. Der Letztautor der Studie zeichnet das Bild einer völlig vernarbten, aber starken Myelomzelle, die durch den Kampf gegen die zahlreichen Medikamentenklassen noch stärker geworden ist.
Hepta-refraktär ist das neue „Normal“ im klinischen Alltag
In den letzten Jahrzehnten hat keine andere hämatologische Krebserkrankung mehr neue Medikamentenzulassungen erlebt als das Multiple Myelom, darunter einige der modernsten Wirkstoffklassen. Dennoch bleibt die Erkrankung bislang unheilbar. Patientinnen und Patienten, die gegenüber zwei immunmodulatorischen Substanzen (IMiDs), zwei Proteasom-Inhibitoren (PIs) und einem CD38-Antikörper resistent sind, werden als „penta-refraktär“ bezeichnet. Früher betrug ihr medianes Überleben nur 5,6 Monate. Durch das Aufkommen neuartiger Immuntherapien, wie CAR-T-Zellen und bispezifische T-Zell-aktivierende Antikörper (T-Cell Engagers, TCE), die gegen Plasmazell-Antigene wie BCMA und GPRC5D gerichtet sind, haben sich die Behandlungsergebnisse für diese Patientengruppe deutlich verbessert. Ein Drittel der Patientinnen und Patienten sind fünf Jahre nach der CAR-T-Zellbehandlung noch rezidivfrei. Bei den meisten Patienten konnten diese neuen Immuntherapien bislang jedoch kein dauerhaftes Überlebensplateau erreichen, viele erleiden letztlich einen Rückfall. Diese „hepta-refraktären“ Patienten (penta-refraktär plus Resistenz gegenüber BCMA- und GPRC5D-gerichteten Therapien) werden im klinischen Alltag zunehmend häufiger gesehen. Am UKW werden derzeit rund 40 hepta-refraktäre Patientinnen und Patienten betreut. Solange die Erkrankung nicht geheilt werden kann, wird dieses hepta-refraktäre Stadium laut Leo Rasche bald das neue „Normal“.
Publikation: Riedhammer, C., Truger, M., Lee, H. et al. The evolution to hepta-refractory myeloma involves sequential loss of CD38, BCMA and GPRC5D. Leukemia (2026). https://doi.org/10.1038/s41375-026-02889-3
Text: Kirstin Linkamp / Wissenschaftskommunikation