Würzburg. Für Patientinnen und Patienten mit fortgeschrittenen oder seltenen Krebserkrankungen ist die Präzisionsonkologie ein wichtiger Bestandteil ihrer Behandlung. Insbesondere an Universitätskliniken wurden hierzu molekulare Tumorboards eingerichtet, wo auf Basis einer umfassenden molekulargenetischen Diagnostik maßgeschneiderte Therapien gesucht und ermöglicht werden. Doch haben tatsächlich alle Patientinnen und Patienten gleichermaßen Zugang zu dieser innovativen Form der personalisierten Medizin? Dieser Frage gingen Forscherinnen und Forscher der WERA Allianz nach. Die vier onkologischen Spitzenzentren Würzburg, Erlangen, Regensburg und Augsburg bilden die Comprehensive Cancer Center Allianz WERA (CCC WERA) und sind seit Februar 2023 Standort des Nationalen Centrums für Tumorerkrankungen (NCT).
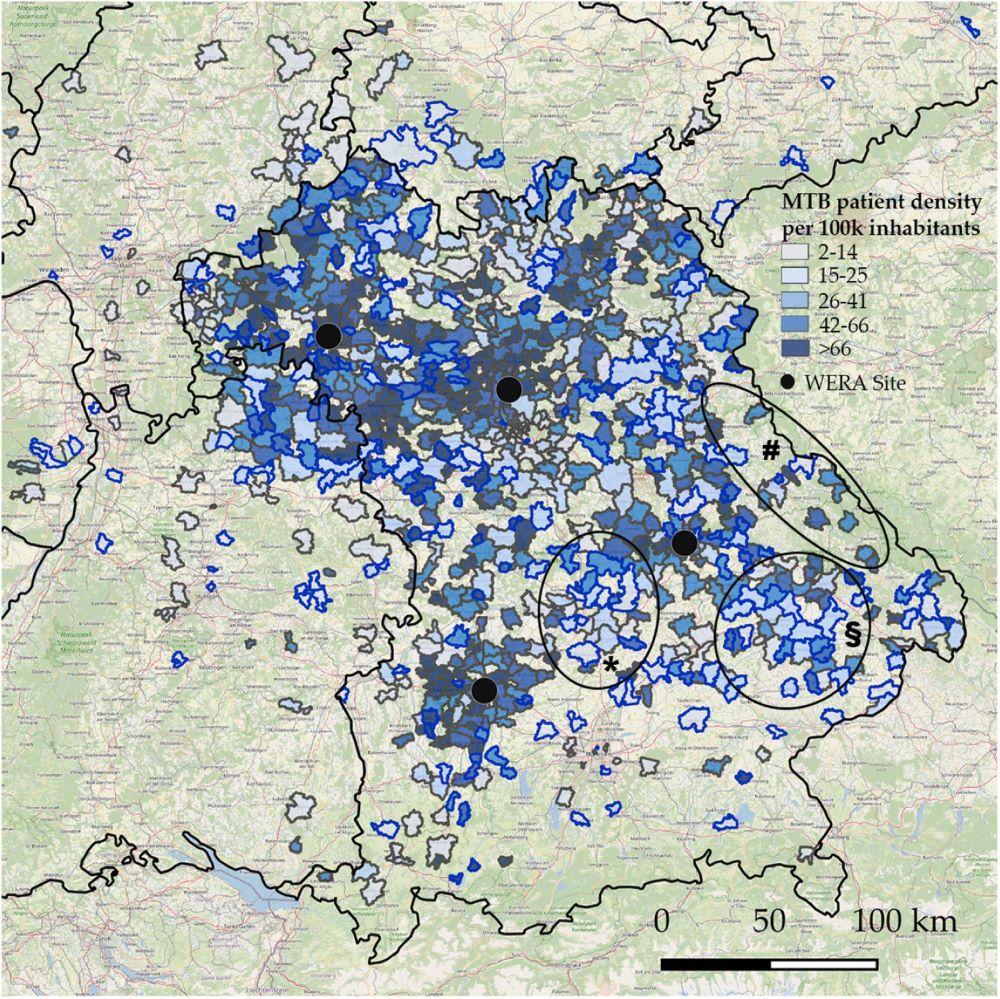
Die WERA Allianz deckt in Bayern ein gemeinsames Versorgungsgebiet mit rund acht Millionen Einwohnerinnen und Einwohnern ab, das überwiegend ländlich geprägt ist. Um die Reichweite ihrer Allianz in der Präzisionsonkologie zu messen, haben die Forschenden ein Modell aus der strategischen Managementlehre, die sogenannte Growth-Share-Matrix*, übernommen, um für mehr als 800 Postleitzahlengebiete ihren Anteil an der gesamten Krebsversorgung mit der regionalen Nutzung von molekularen Tumorboards in der WERA Allianz zu vergleichen.
Ihre Studie identifizierte Regionen wie Bad Mergentheim, Bamberg und Bayreuth, die trotz ihrer Entfernung zu den WERA-Zentren einen hohen Anteil an Vorstellungen in den Molekularen Tumorboards aufwiesen. Diese Ergebnisse deuten auf eine erfolgreiche Zusammenarbeit mit den regionalen Partnern hin. „Das ist der Idealfall, wenn die allgemeine Krebsversorgung vor Ort genutzt wird und WERA den Zugang zur Präzisionsonkologie sicherstellt“, bemerkt Dr. Markus Krebs, der korrespondierende Autor der Studie. Der Arzt im Molekularen Tumorboard am Standort Würzburg hat vor dem Medizinstudium ein Betriebswirtschaftsstudium abgeschlossen, ist also prädestiniert für die Patientenzugangsforschung, die ihm zufolge in Deutschland noch in den Kinderschuhen stecke.
Gemeinsam mit zahlreichen WERA-Kolleginnen und -Kollegen, allen voran Dr. Florian Lüke, dem klinischen Leiter des Regensburger molekularen Tumorboards sowie Dr. Alexander Kerscher, dem Geschäftsführer des Zentrums für Personalisierte Medizin (ZPM) in Würzburg, hat er die WERA Cancer Center Matrix im European Journal of Cancer veröffentlicht.
Im Fokus: „Weiße Flecken“ in der präzisionsonkologischen Versorgung
Die WERA-Matrix zeigte jedoch nicht nur eine erfolgreiche Zusammenarbeit, sondern auch „Weiße Flecken“ mit einem potenziellen Nachholbedarf in der Präzisionsonkologie. Sie machte Postleitzahlengebiete transparent, aus denen zahlreiche Patientinnen und Patienten zwar eine Krebsbehandlung durch WERA erhielten, jedoch wenige oder keine Vorstellungen in den molekularen Tumorboards erfolgten. Für diese geographisch oftmals zusammenhängenden Gebiete stellt sich die Frage: Liegt es an der infrastrukturellen Erreichbarkeit der WERA-Standorte? Übernehmen andere Versorger die Krebsversorgung? Oder sind die molekularen Tumorboards dort schlicht unbekannt?
„Diese Regionen müssen wir uns gezielt anschauen, uns bei den onkologischen Praxen und Krankenhäusern vorstellen und unsere Unterstützung anbieten“, kommentiert Dr. Florian Lüke. Gleichzeitig erhoffen sich die Forschenden durch dieses Vorgehen ein besseres Verständnis davon, welche Faktoren tatsächlich einen kritischen Einfluss auf den Patientenzugang zur Präzisionsonkologie haben.
In Planung: Ausweitung der Methodik auf andere Regionen
„Die WERA-Matrix ist von Praktikern für Praktiker entwickelt worden. Wir sehen unmittelbar, wo wir die Versorgung krebskranker Menschen möglicherweise noch verbessern können. Wir sehen aber auch, wo die Zusammenarbeit mit regionalen Partnern bereits sehr gut funktioniert“, freut sich Dr. Markus Krebs.
Um die weitere Entwicklung der Präzisionsonkologie in der WERA Allianz zu verfolgen, sollen die Versorgungsdaten künftig regelmäßig mit Hilfe der WERA Matrix ausgewertet werden.
„Das Schöne an unserer Methodik ist, dass wir auch andere Fragestellungen ergänzen können – beispielsweise, welche Patientinnen und Patienten aus welchen Regionen in innovative klinische Studien eingeschlossen werden“, sagt Dr. Alexander Kerscher. Zusammen mit Forschenden aus ganz Deutschland hat er von der Deutschen Krebshilfe jetzt eine Förderung erhalten, um das Konzept der WERA Matrix auf weitere onkologische Spitzenzentren zu übertragen.
*Als Grundlage diente das Vier-Quadranten-Matrix-Modell, auch als BCG-Matrix bekannt, das Produkte nach den Kriterien Marktanteil und Marktwachstum in ein Portfolio einordnet. In der WERA-Matrix wurden die Produkte durch Postleitzahlen ersetzt, wobei die präzisionsonkologische Versorgung dem Marktwachstum auf der y-Achse und die allgemeine Krebsversorgung dem Marktanteil auf der x-Achse entsprach. Die Größe der Punkte in den vier Quadranten spiegelt die Bevölkerungszahl der Postleitzahlgebiete wider. Unten rechts befindet sich zum Beispiel Quadrant IV mit Gebieten, in denen WERA einen vergleichsweise hohen Anteil der allgemeinen Krebsversorgung übernimmt. Gleichzeitig werden aus diesen Regionen jedoch wenige Patientinnen und Patienten in den molekularen Tumorboards der WERA Allianz untersucht.
Publikation:
Markus Krebs, Florian Haller, Silvia Spörl, Elena Gerhard-Hartmann, Kirsten Utpatel, Katja Maurus, Volker Kunzmann, Manik Chatterjee, Vivek Venkataramani, Imad Maatouk, Max Bittrich, Tatjana Einwag, Norbert Meidenbauer, Lars Tögel, Daniela Hirsch, Wolfgang Dietmaier, Felix Keil, Alexander Scheiter, Alexander Immel, Daniel Heudobler, Sabine Einhell, Ulrich Kaiser, Anja M. Sedlmeier, Julia Maurer, Gerhard Schenkirsch, Frank Jordan, Maximilian Schmutz, Sebastian Dintner, Andreas Rosenwald, Arndt Hartmann, Matthias Evert, Bruno Märkl, Ralf Bargou, Andreas Mackensen, Matthias W. Beckmann, Tobias Pukrop, Wolfgang Herr, Hermann Einsele, Martin Trepel, Maria-Elisabeth Goebeler, Rainer Claus, Alexander Kerscher, Florian Lüke. The WERA cancer center matrix: Strategic management of patient access to precision oncology in a large and mostly rural area of Germany. European Journal of Cancer, Volume 207, 2024, 114144, ISSN 0959-8049, https://doi.org/10.1016/j.ejca.2024.114144.
Das Nationale Centrum für Tumorerkrankungen (NCT) WERA
Das Nationale Centrum für Tumorerkrankungen (NCT) WERA ist eine gemeinsame Einrichtung des Deutschen Krebsforschungszentrums (DKFZ), des Universitätsklinikums Würzburg, der Julius-Maximilians-Universität Würzburg, des Universitätsklinikums Erlangen, der Friedrich-Alexander-Universität Erlangen-Nürnberg, des Universitätsklinikums Regensburg, der Universität Regensburg, des Universitätsklinikums Augsburg und der Universität Augsburg. Neben WERA (Würzburg, Erlangen, Regensburg, Augsburg) gibt es fünf weitere NCT Standorte in Deutschland: Berlin, Dresden, Heidelberg, SüdWest (Tübingen-Stuttgart/Ulm) und West (Essen/Köln).
Das NCT hat es sich zur Aufgabe gemacht, Forschung und Krankenversorgung so eng wie möglich zu verknüpfen. Damit können Krebspatientinnen und -patienten an den NCT Standorten auf dem jeweils neuesten Stand der wissenschaftlichen Erkenntnisse behandelt werden. Gleichzeitig erhalten die Wissenschaftlerinnen und Wissenschaftler durch die Nähe von Labor und Klinik wichtige Impulse für ihre praxisnahe Forschung. Gemeinsamer Anspruch der NCT Standorte ist es, das NCT zu einem internationalen Spitzenzentrum der patientennahen Krebsforschung zu entwickeln.
Text: Kirstin Linkamp / UKW