Hirnvenenthrombosen sind eine seltene Form von Hirndurchblutungsstörungen, die im Gegensatz zum klassischen Schlaganfall, häufiger auch jüngere Menschen betrifft. Aus weitgehend ungeklärter Ursache entstehen Blutgerinnsel
(Thromben) in Hirnvenen, behindern den Blutabfluss und führen so zur Schädigung des Hirngewebes. Im Frühjahr 2021 gelangten Hirnvenenthrombosen als sehr seltene Nebenwirkung einer Corona-Impfung mit Vektor-basierten Impfstoffen ins öffentliche Bewusstsein. Mittlerweile belegen epidemiologische Studien für Patienten und Patientinnen die an Covid-19 erkranken, ein vielfach erhöhtes Risiko für diese gravierende Komplikation.
Wissenschaftler und Wissenschaftlerinnen des Rudolf-Virchow-Zentrums – Center for Integrative and Translational Bioimaging der Universität Würzburg (RVZ) und des Universitätsklinikums Würzburg, die gemeinsam mit Kollegen und Kolleginnen aus Tübingen und Greifswald im Sonderforschungsbereich Transregio (SFB TR) 240 forschen, konnten jetzt erstmals zeigen, dass die Aktivierung zweier spezifischer Rezeptoren auf der Oberfläche von Blutplättchen (Thrombozyten) zu Hirnvenenthrombosen führt. „Diese überraschende Erkenntnis könnte Grundlage für eine neue, hochwirksame Therapie dieser seltenen, aber gravierenden Erkrankung sein“, erklärt der Leiter der Studie, Prof. Dr. Bernhard Nieswandt (Lehrstuhl für Experimentelle Biomedizin I), der auch Sprecher des SFB TR 240 ist.
Das Zusammenspiel zweier Thrombozytenrezeptoren führt zu Hirnvenenthrombosen
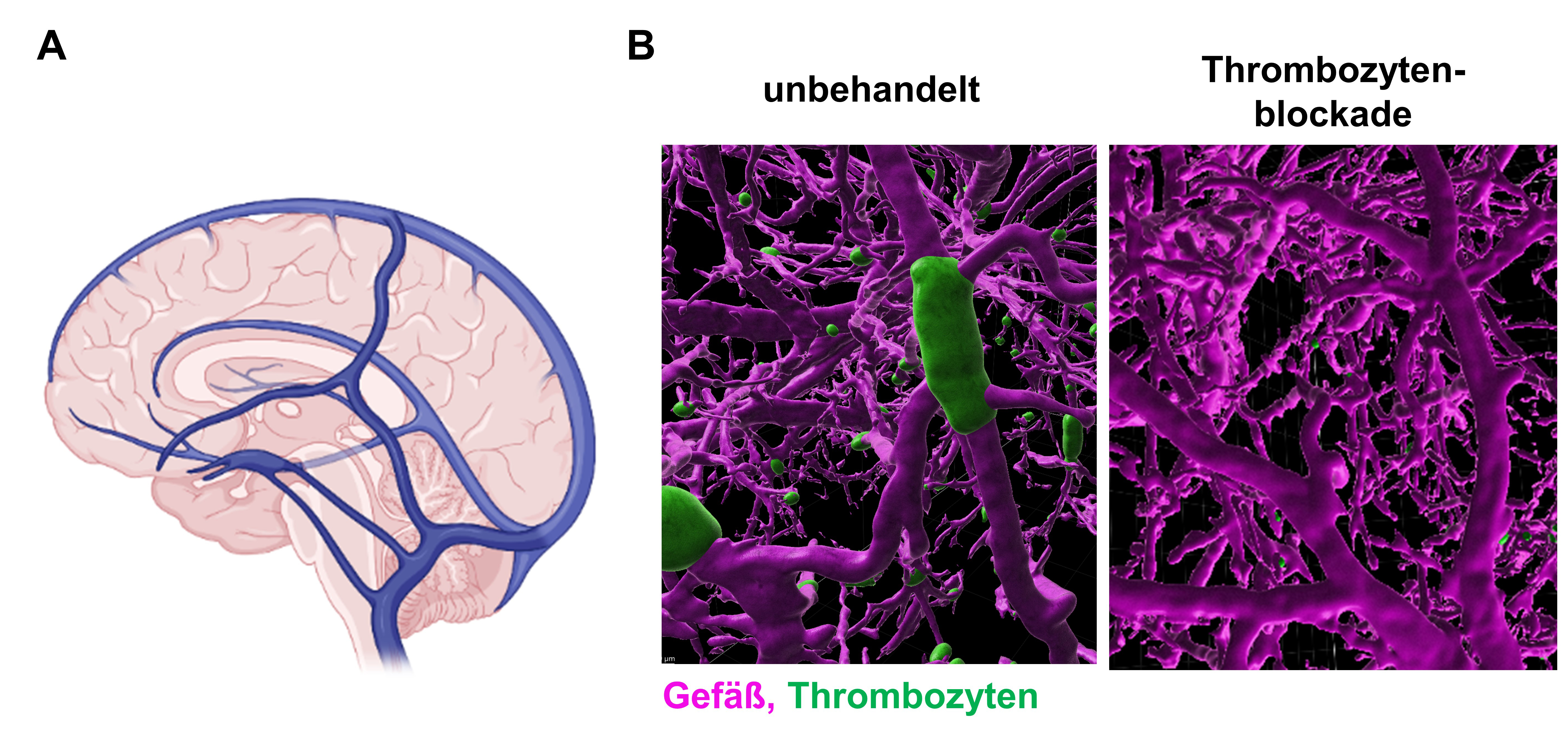
Bislang waren die molekularen Prozesse bei der Entstehung einer Hirnvenenthrombose weitestgehend unverstanden und es gab auch keine geeigneten Modelle zu ihrer Erforschung. Bekannt waren als Risikofaktoren das Wochenbett nach Entbindung, die orale Schwangerschaftsverhütung und Infektionen. „Eigentlich wollten wir untersuchen, ob ein Antikörper gegen den Rezeptor CLEC-2 auf Thrombozyten bei Verabreichung in die Blutbahn die Blutungsneigung erhöht. Völlig unerwartet löste der Antikörper dann aber, neben einem Abfall der Thrombozytenzahl, Krampfanfälle und weitere neurologische Ausfälle bei den behandelten Tieren aus. Symptome, die denen von Patienten mit akuter Hirnvenenthrombose sehr ähnelten. Tatsächlich zeigten weitergehende Untersuchungen, dass die Tiere binnen weniger Minuten ausgeprägte Hirnvenenthrombosen entwickelt hatten, ohne das es in anderen Organen zur Gerinnselbildung kam“, erklärt Prof. Dr. David Stegner, Leiter der Arbeitsgruppe Vaskuläre Bildgebung am RVZ und einer der beiden Erstautoren der Studie. „Wir vermuten, dass die Bindung des Antikörpers die Eigenschaften des Rezeptors CLEC-2 so verändert, dass er Signale in die Zelle weiterleitet. Dies aktiviert die Thrombozyten, sie verklumpen im venösen Gehirnkreislauf und lösen dadurch die Hirnvenenthrombosen aus. Ein Rätsel ist, warum nur die Hirnvenen betroffen sind“, ergänzt Stegner. Die Forschergruppe fand heraus, dass neben CLEC-2 auch noch ein zweiter Thrombozytenrezeptor, nämlich GPIIb/IIIa, an der Entstehung von Hirnvenenthrombosen beteiligt ist und nur das Zusammenwirken beider Rezeptoren zur Thrombenbildung im Gehirn führt.
Thrombozytenblockade als neuer Therapieansatz
Diese Erkenntnisse ermöglichten es nun, sehr gezielt nach Wirkstoffen zur Blockade so entstehender Hirnvenenthrombosen zu suchen. Ein Blutgerinnsel entsteht durch das Zusammenspiel zweier Prozesse: der plasmatischen Gerinnung und der Thrombozytenaktivierung. Bei der Behandlung venöser Thrombosen wird im Allgemeinen auf Heparin, als Hemmstoff der plasmatischen Gerinnung, gesetzt. Bei den hier untersuchten Hirnvenenthrombosen im Tierexperiment hatte Heparin allerdings nur einen vergleichsweise geringen schützenden Effekt. Heparin ist aber das Standardmedikament bei der Akutbehandlung von Patienten mit Hirnvenenthrombosen, außer wenn diese als Komplikation im Zusammenhang mit einer Corona-Impfung auftreten.
Die Wissenschaftlerinnen und Wissenschaftler konzentrierten sich daraufhin auf die Thrombozytenrezeptoren. Wurden diese vorab blockiert, bildete sich keine Hirnvenenthrombose. „Das interessanteste Ergebnis war allerdings, dass eine Hemmung der Thrombozyten durch die Blockade des GPIIb/IIIa-Rezeptors, auch nach dem Einsetzen der neurologischen Symptome, also im akuten Krankheitsverlauf äußerst wirksam war“, sagt Vanessa Göb, ebenfalls Erstautorin der Studie. Die Gruppe zeigte, dass die Rezeptorblockade das Wachstum der Blutgerinnsel in den Hirnvenen unmittelbar stoppte, die behandelten Tiere sich vollständig erholten und keine Blutungskomplikationen auftraten. Dies ist für eine mögliche Übertragung dieses Therapieansatzes auf Patienten von erheblicher Bedeutung. Prof. Dr. Guido Stoll von der Neurologischen Klinik ergänzt: „Diese Ergebnisse waren überraschend und könnten den Weg weisen für den Einsatz von GPIIb/IIIa-Blockern bei den Patienten, bei denen die Hirnvenenthrombosen trotz Heparinbehandlung fortschreiten, was häufig zum Tode führt. GPIIb/IIIa-Blocker sind für andere kardiovaskuläre Erkrankungen bereits zugelassen.“
Ein Schlüssel für den Erfolg dieses Projektes lag in der interdisziplinären Zusammenarbeit verschiedener Fachgebiete im Rahmen des Sonderforschungsbereichs Transregio 240 „Thrombozyten – molekulare, zelluläre und systemische Funktionen unter physiologischen und pathologischen Bedingungen“ (Würzburg – Tübingen), der seit 2018 durch die Deutsche Forschungsgemeinschaft gefördert wird.
Publikation
David Stegner, Vanessa Göb, Viola Krenzlin, Sarah Beck, Katherina Hemmen, Michael K. Schuhmann, Barbara F. Schörg, Christian Hackenbroch, Frauke May, Philipp Burkard, Jürgen Pinnecker, Alma Zernecke, Peter Rosenberger, Andreas Greinacher, Bernd J. Pichler, Katrin G. Heinze, Guido Stoll, and Bernhard Nieswandt: Foudroyant cerebral venous (sinus) thrombosis triggered through CLEC-2 and GPIIb/IIIa dependent platelet activation. Nature Cardiovascular Research (Februar 2022) DOI: 10.1038/s44161-021-00017-1.
Kontakt
Prof. Dr. Bernhard Nieswandt (Rudolf-Virchow-Zentrum, Universität Würzburg)Tel.: + 49 931 31-80405, bernhard.nieswandt@virchow.uni-wuerzburg.de
Dr. Judith Flurer (Pressestelle, Rudolf-Virchow-Zentrum)
Tel.: +49 931 31-85822, judith.flurer@virchow.uni-wuerzburg.de
Pressemitteilung der Universität Würzburg vom 10.02.2022