Würzburg. Bei fast allen soliden Tumoren - also Krebserkrankungen mit fester Gewebestruktur - gilt der Nachweis von Tumorzellen in den Lymphknoten als entscheidender Marker für das Fortschreiten der Krankheit. Ein Lymphknotenbefall hat maßgeblichen Einfluss auf die Therapieentscheidung und die Überlebenschancen der Patientinnen und Patienten. Vor allem solide Tumore in der Brust, auf der Haut oder im Magen-Darm-Trakt nutzen das Lymphsystem als Hauptweg zur Fernmetastasierung, beispielsweise in die Lunge, die Leber und die Knochen. Dabei spielen Lymphknoten eigentlich eine wichtige Rolle im Immunsystem. Sie dienen als Treffpunkt für verschiedene Immunzellen, die gemeinsam Krankheitserreger erkennen und bekämpfen.
Genau diese Schnittstelle zwischen Metastasierung und Immunität ist das Forschungsgebiet von Dr. Angela Riedel, molekulare Biotechnologin und Juniorgruppenleiterin am Mildred-Scheel-Nachwuchszentrum (MSNZ) am Uniklinikum Würzburg (UKW). Ihre neuesten Entdeckungen veröffentlichte sie gerade in Immunity, einer der renommiertesten Fachzeitschriften in der Immunologie. Mit ihrem kleinen Team gelang es ihr, eine umfangreiche und umfassende Studie durchzuführen, die sowohl Daten von Patientinnen als auch Mausmodellen umfasste und eine Vielzahl von Experimenten zur Generierung und Untermauerung der Hypothesen beinhaltete.
Gemeinsam schauten sie sich die Lymphknoten von Mausmodellen und Patientinnen mit triple-negativem Brustkrebs (TNBC) an. Dabei handelt es sich um eine aggressive Form des Mammakarzinoms, die etwa zehn bis 15 Prozent aller Brustkrebserkrankungen ausmacht und häufig junge Frauen betrifft. Zielgerichtete Standardtherapien wie die moderne Hormontherapien kommen hier aufgrund eines Mangels an drei Schlüsselmerkmalen nicht in Frage.
Prämetastatisches Milieu im Lymphknoten – Monozyten werden korrupt, FRCs zu Komplizen
Im Fokus ihrer Untersuchungen stand der Tumor-drainierende Lymphknoten, der dem Brustkrebs am nächsten ist. Da er als Erster die vom Tumor ausgeschüttete Flüssigkeit filtert, wird er auch als Wächterlymphknoten (Sentinel Lymph Node, SLN) bezeichnet. Angela Riedel konnte mit ihrer Arbeitsgruppe erstmals nachweisen, dass der Tumor bereits vor seiner Ansiedlung die Umgebung der drainierenden Lymphknoten manipuliert. Dies führt zu einer veränderten Immunantwort, die wiederum die Entstehung von Fernmetastasen begünstigt.
„Wir müssen die Metastasierung noch besser verstehen, um sie verhindern zu können“, betont Angela Riedel. „Denn das Wachsen von Metastasen in überlebenswichtigen Organen stellt ein erhebliches Hindernis für die erfolgreiche Behandlung von Brustkrebs Patientinnen dar. Indem wir jedoch den Immunevasionsmechanismus im Lymphknoten adressieren, können wir das Metastasierungsrisiko verringern.“
Als Hauptakteure für die Umprogrammierung der Lymphknoten identifizierte ihre Arbeitsgruppe die sogenannten fibroblastischen Retikulumzellen (FRCs). Diese bilden das strukturelle Gerüst der Lymphknoten und setzen über die Zytokine CCL2 und CCL7 spezielle Signale frei, die Monozyten anziehen. Monozyten sind die größten Zellen der weißen Blutkörperchen und spielen eine Schlüsselrolle im Immunsystem. Das Team von Angela Riedel beobachtete jedoch, dass die Monozyten in den TNBC-Lymphknoten korrupt wurden und die Aktivität von T-Zellen blockierten, die normalerweise für die Zerstörung von Krebszellen verantwortlich sind.
Metastatische Nischen bieten Schutzraum für Tumorzellen
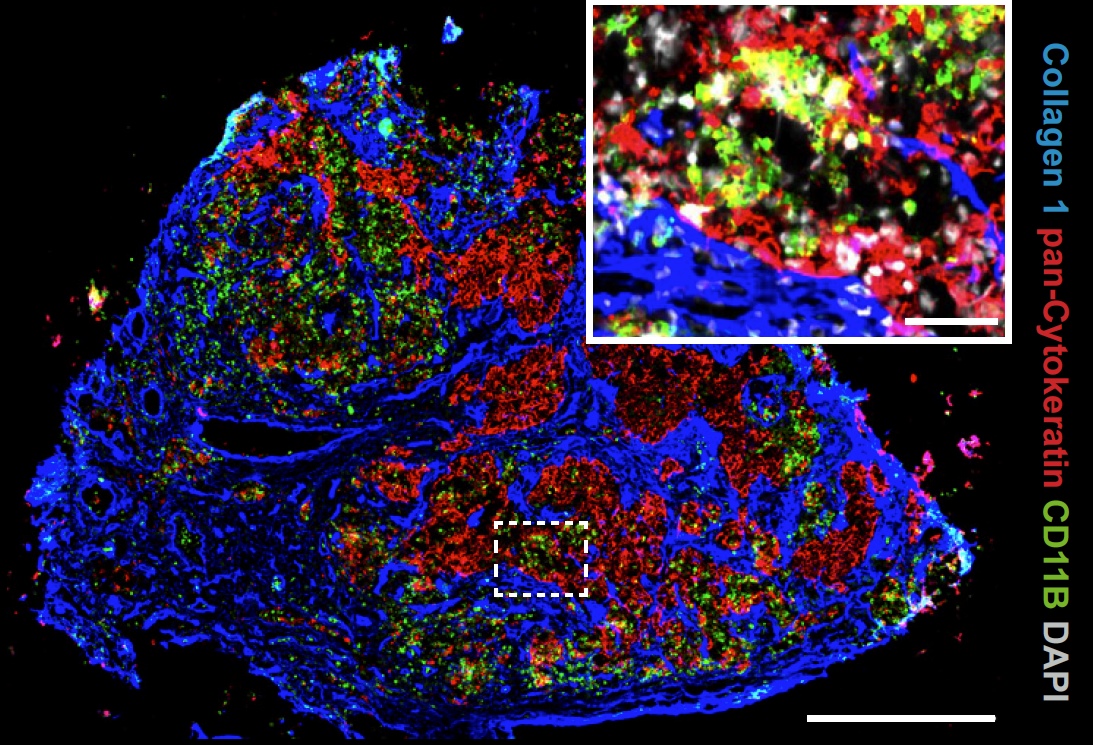
„Mithilfe neuester Methoden, wie der räumlichen Transkriptomik, der Einzelzell-RNA-Sequenzierung, der Proteomik, und der Immunfluoreszenz, die wir eigenständig im Labor etabliert haben, konnten wir entschlüsseln, dass sich diese suppressiven Monozyten zusammen mit FRCs und T-Zellen in bestimmten Nischen innerhalb der Lymphknoten ansammeln“, berichtet Moutaz Helal, der gemeinsam mit Greta Mattavelli Erstautor der hochrangig publizierten Studie ist. Er verstärkt seit April 2020 die AG Riedel im Rahmen seiner Masterarbeit und seit Oktober 2021 als Doktorand. Nach seinem Bachelor-Abschluss in Pharmazie in Ägypten absolvierte er seinen Master im Bereich Molekulare Onkologie im Rahmen des Biochemie-Studiengangs an der Universität Würzburg. Im MSNZ entdeckte er schließlich seine Liebe zur Bioinformatik. Die herausragend gute und moderne Ausstattung des MSNZ und die der Core Facilities auf dem Campus, sind ihm zufolge außergewöhnlich.
Doch wie kommt es dazu, dass die FRCs die Immunflucht unterstützen und die Bildung dieser gefährlichen prä-metastatischer Nischen begünstigen? Das Team konnte zeigen, dass die FRCs über den Toll-like-Rezeptor 4 (TLR4) aktiviert werden. TLR4 ist eigentlich ein Sensor auf der Oberfläche von Zellen des Immunsystems, der wie eine Alarmanlage funktioniert und Gefahren meldet. Manchmal wird er jedoch vom Tumor missbraucht, um das Immunsystem zu bremsen.
Weniger Metastasen in der Lunge durch gezielte TLR4-Blockade
Die Arbeitsgruppe stellt sich die Frage: Was passiert, wenn dieser Rezeptor gezielt im drainierenden Lymphknoten blockiert wird? „Unsere Untersuchungen an Mäusen ergaben, dass sich durch die gezielte Inhibition in Kombination mit einer modernen PD1-Immuntherapie die T-Zell-Aktivität wiederherstellen lässt und die Fernmetastasierung in der Lunge signifikant reduziert wird“, berichtet Greta Mattavelli. „A day to remember“, nennt die gebürtige Italienerin den Tag, an dem sie erstmals gesehen hat, dass die Therapie im Mausmodell Erfolg hat. Greta Mattavelli begann ihre Promotion im Oktober 2020 als erste Doktorandin im Labor von Angela Riedel. Ihren Bachelor und Masterabschluss in Medizinischer und Molekularer Biotechnologie erwarb sie in Mailand. In der Studie betreute sie die Laborarbeiten, was zum Teil Nachtschichten und Wochenendeinsätze des gesamten Teams erforderte. Und die Wege über den Campus zur Frauenklinik und Pathologie sind ihr mehr als geläufig.
In Zusammenarbeit mit der von Prof. Dr. Achim Wöckel geleiteten Frauenklinik am UKW und dem von Prof. Dr. Andreas Rosenwald geleiteten Institut für Pathologie konnte das Team in Proben von Patientinnen bestätigen, dass der gleiche Prozess auch beim Menschen mit TNBC zu erkennen ist. Somit besteht die Möglichkeit, dass Therapien, die auf diese Lymphknotenumgebung abzielen, auch die Aussichten für Patientinnen mit aggressivem Brustkrebs verbessern könnten.
PD-L1 auf Monozyten im Lymphknoten als Marker für PD-1-Immuntherapie
Bereits Anfang 2018 wurde bei Vorliegen einer PD-L1-Expression auf dem Primärtumor eine Immuntherapie, in der Regel in Kombination mit einer Chemotherapie, als Erstlinienbehandlung in klinischen Leitlinien etabliert. Hintergrund: Das vom Tumor exprimierte Oberflächenprotein PD-L1 (Programmed Death Ligand 1) bindet sich an den PD-1-Rezeptor auf T-Zellen und signalisiert diesen, den Tumor nicht anzugreifen. Eine Immuntherapie mit Antikörpern blockiert diese Bindung, sodass der Tumor seine Tarnung verliert und die körpereigenen T-Zellen wieder ihre natürliche Abwehrkraft entfalten können. PD-L1 befindet sich jedoch auch – oft in erhöhter Konzentration – auf Monozyten im prämetastatischen Gewebe der Lymphknoten. Eine PD-1-Immuntherapie, welche die Bremse löst und die T-Zellen wieder aktiviert, könnte demnach auch unabhängig von der immunhistochemischen Analyse des Mammakarzinoms in der frühen Phase von Brustkrebs wirkungsvoll sein. Laut Riedel könnte daher auch die Expression von PD-L1 auf Zellen des Tumor-drainierenden Lymphknotens als Marker und Kriterium für eine PD-1-Immuntherapie untersucht werden.
Ferner laufen in der AG Riedel weitere Untersuchungen zur Verabreichung der Immuntherapie – systemische Therapie versus lokale Therapie. Im Brustkrebs-Mausmodell haben die Forschenden bereits beobachtet, dass die Immuntherapie besser wirkt, wenn sie subkutan, möglichst nah an den Lymphknoten, verabreicht wird. Auch die Wahl der Chemotherapie, die mit der Immuntherapie kombiniert wird, wird überprüft. Ein weiterer Schritt ist die Identifizierung von Patientengruppen, die von einer verbesserten Immuntherapie basierend auf ihrem Ansatz profitieren würden.
„Dr. Angela Riedel ist eine exzellente Wissenschaftlerin und ihre gelungene Arbeit richtungsweisen“, lobt Prof. Dr. Achim Wöckel, Direktor der Würzburger Universitäts-Frauenklinik. „Tripel-Negativer Brustkrebs ist aufgrund der Metastasierungsmuster trotz wirksamer Therapien weiterhin eine hoch aggressive Erkrankung. Ich freue mich sehr, dass wir gemeinsam mit der Arbeitsgruppe von Angela Riedel mehr Verständnis zu den Interaktionen von Tumorzellen und Immunsystem erlangen. Diese Projekte sind verbunden mit dem langfristigen Ziel innovative Therapieoptionen zur Vermeidung oder Reduktion einer Ausbreitung des Tumors zu entwickeln und deren Effektivität zu prüfen.“
Das Immunsystem gewinnt auch im Alltag eine immer größere Bedeutung in der Krebsbehandlung
Dass das Immunsystem immer mehr in den Fokus der Behandlung von Krebs und anderen Erkrankungen rückt und neueste Erkenntnisse zeitnah in die Therapieempfehlungen einfließen findet Angela Riedel nicht nur spannend, sondern auch erfreulich. So kann man selbst mit einfachen Mitteln wie Sport, Bewegung, Stressmanagement und einer gesunden Ernährung das Immunsystem und die Metastasierung positiv beeinflussen. Dazu gibt es zahlreiche Publikationen, darunter auch eine von ihr. Vor drei Jahren veröffentlichte sie im Journal Cancer Immunology Research, wie Milchsäure, die Tumore bei der Glykolyse ausschütten, die nachgeschalteten Lymphknoten reprogrammieren und die Immunabwehr blockieren.
Kurze Zeit später zeigte sie gemeinsam mit Prof. Dr. Leo Rasche in der Fachzeitschrift Blood, wie unterschiedlich die Mikroumgebung von Myelomzellen und extramedullären Läsionen auf das Immunsystem reagiert.
Mehrere Millionen Euro Drittmittel eingeworben
Angela Riedel studierte Molekulare Biotechnologie an der Universität Bielefeld und promovierte im Fach Molekulare Onkologie an der University of Southern Denmark in Odense. Ab 2013 arbeitete sie als Postdoktorandin an der MRC Cancer Unit der University of Cambridge, bevor sie 2017 zum Deutschen Krebsforschungszentrum in Heidelberg wechselte. 2020 übernahm sie am Mildred-Scheel-Nachwuchszentrum (MSNZ) in Würzburg die Leitung einer Juniorgruppe und hat seitdem mit Kooperationspartnern mehr als vier Millionen Euro Drittmittel eingeworben. Neben der Deutschen Krebshilfe, welche das MSNZ fördert, unterstützen die Multiple Myeloma Research Foundation (MMRF), die Else Kröner Fresenius Stiftung, die Wilhelm Sander Stiftung, das Interdisziplinäre Zentrum für Klinische Forschung (IZKF) und die Stiftung „Forschung hilft“ ihre Forschung.
Publikation: Greta Mattavelli, Moutaz Helal, Ana Cetkovic, Maximilian J. Krämer, Saskia-Laureen Herbert, Kilian Mielert, Tanja Schlaiß, Anna Frank, Emily Riemer, Mara John, Josefina del Pilar, Martinez Vasquez, Laura Kindl, Jonathan J. Swietlik, Benedikt O. Gansen, Marion Krafft, Emilia Stanojkovska, Hanna Fischer, Ute-Susann Albert, Jonas Bauer, Murilo Delgobo, Arpa Aintablian, Haisam Alattar, Manfred B. Lutz, Felix Meissner, Thordur Oskarsson, Leo Rasche, Gustavo Ramos, Andreas Rosenwald, Achim Wöckel, Angela Riedel. A TLR4-dependent fibroblast-monocyte axis in tumor-draining lymph nodes contributes to metastasis in triple-negative breast cancer. Immunity. 2025. ISSN 1074-7613. https://doi.org/10.1016/j.immuni.2025.08.015.
Text: Wissenschaftskommunikation / KL