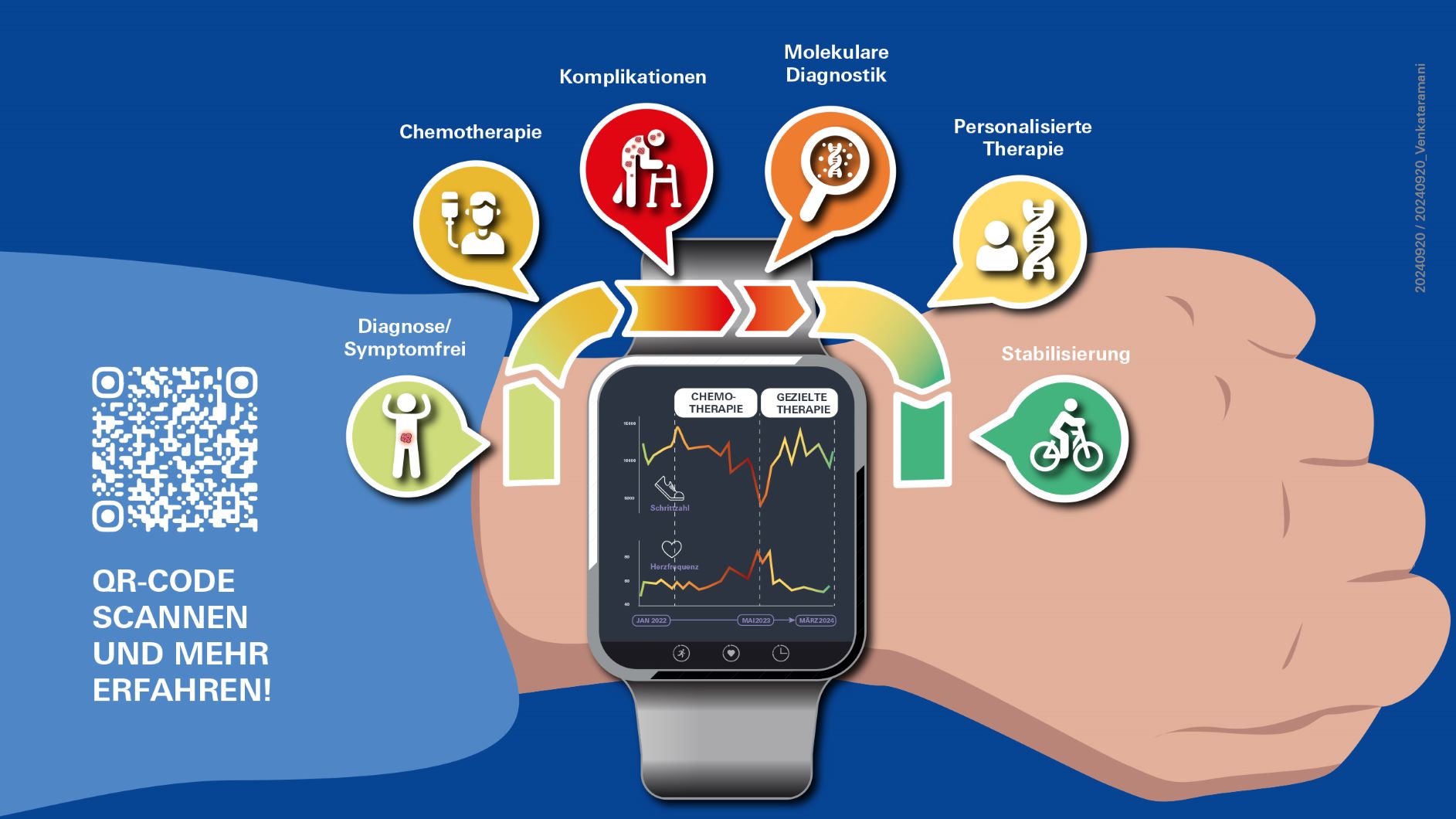

Würzburg. Seine Smartwatch zeigte ihm schon früh, dass er diesmal auf dem richtigen Weg war - noch bevor konventionelle Methoden wie radiologische Bildgebung und Blutuntersuchungen die Wirksamkeit der Therapie belegen konnten. Der 56-jährige Patient trug den Fitnesstracker bereits bei den vorangegangenen Chemotherapien am Handgelenk. Doch erst bei der präzisionsonkologischen Behandlung, die exakt auf die Eigenschaften seines großzelligen neuroendokrinen Pankreaskarzinoms zugeschnitten war, deuteten die täglich gemessenen Schrittzahlen und der Ruhepuls frühzeitig auf einen Erfolg hin.
Der Fallbericht, den ein Team des Comprehensive Cancer Centers Mainfranken (CCC MF) am Uniklinikum Würzburg (UKW) jetzt im Journal npj Precision Oncology veröffentlicht hat, ist in mehrfacher Hinsicht besonders. Die Publikation zeigt nicht nur die mögliche Wirksamkeit präzisionsonkologischer Behandlungen, sondern auch das medizinisch hilfreiche Potenzial digitaler Instrumente wie Smartwatches. Diese könnten die Überwachung von Krebsbehandlungen positiv beeinflussen und so eine schnelle Anpassung der Therapie ermöglichen.
RET-Inhibitor schaltet gezielt die Wirkung der Genveränderung aus
„Unser Patient litt an einer seltenen Form von Bauchspeicheldrüsenkrebs, bei der wir mit Hilfe einer molekulargenetischen Untersuchung eine Veränderung im Erbgut der Tumorzellen nachweisen konnten. Diese sogenannte RET-Gen-Fusion stimuliert das Wachstum der Tumorzellen“, berichtet Privatdozentin Dr. Barbara Deschler-Baier, Oberärztin am Interdisziplinären Studienzentrum (ISZ) des CCC MF und gemeinsam mit Dr. Markus Krebs Erstautorin der Publikation.
Das RET-Gen kodiert normalerweise für ein Protein, das bei Zellprozessen wie Wachstum und Differenzierung eine Rolle spielt. Wenn das RET-Gen jedoch mit einem anderen Gen fusioniert, kann dies zu einer abnormalen Aktivierung des RET-Proteins und damit zu unkontrolliertem Zellwachstum und Krebs führen. Ein RET-Inhibitor blockiert die Aktivität dieses abnormalen Proteins und kann so das Tumorwachstum gezielt hemmen. Seit 2024 ist der RET-Inhibitor Selpercatinib von der Europäischen Arzneimittelagentur als Monotherapie für Patientinnen und Patienten mit entsprechend genetisch veränderten Tumoren zugelassen. Die Zulassung basiert auf den Ergebnissen der laufenden Phase-I/II-Studie LIBRETTO-001, an der auch das CCC MF beteiligt ist. Und eben in diese Studie konnte der Patient erfolgreich eingeschlossen werden.
Erfolgreiche Synthese von präzisionsmedizinischen Ansätzen und digitalen Biomarkern
„Bereits wenige Tage nach Beginn der Therapie spürte der Patient eine deutliche Besserung. Die tastbaren Lymphknoten und Weichteilmetastasen waren geschrumpft, er benötigte weniger Morphium und keine Gehhilfe mehr“, berichtet der Projektleiter der Studie, Privatdozent Dr. Vivek Venkataramani. Er war der erste Patient des Onkologen, der seit Mai 2023 das Team der ISZ verstärkt. Bei diesem Fall sei der Vergleich „wie Phönix aus der Asche“ durchaus berechtigt. Denn so einen Fall sehe man in der Onkologie selten. „Das Monitoring mit der Smartwatch unterstrich den Einfluss von Selpercatinib auf die deutlich verbesserte Lebensqualität und bestätigte die Wirksamkeit der Therapie durch verbesserte körperliche Leistungsindikatoren. Die Messung der Schrittzahl und der Herzfrequenz lieferte einen Echtzeit-Einblick in das Aktivitätsniveau und die physiologischen Reaktionen des Patienten.“
Als der Patient seine drei Chemotherapien erhielt, ging jeder Wechsel mit einer Abnahme der Schrittzahl einher, was den zunehmenden Einfluss der Krankheit und der Nebenwirkungen der Behandlung widerspiegelte. Im Gegensatz dazu markierte die Einführung von Selpercatinib eine positive Wende mit einer klaren und schnellen Zunahme der Schrittzahl, was auf eine verbesserte Mobilität und ein Ansprechen auf die Therapie hindeutete. Gleichzeitig wies eine signifikante Abnahme der durchschnittlichen Ruheherzfrequenz auf eine verringerte systemische Belastung und eine Verbesserung des allgemeinen Gesundheitszustands hin.
Der Zustand des Patienten ist seit über einem Jahr stabil, es sind nur noch minimale Restbefunde vorhanden. Er hat keine Schmerzen mehr, nimmt wieder aktiv am Leben teil, treibt Sport, hat einen deutlich besseren Appetit und sein Gewicht hat sich normalisiert.
Fallbericht motiviert Forschende und Behandelnde
„Unser Fallbericht zeigt, wie moderne Technologien, insbesondere Smartwatches, in der personalisierten Medizin eingesetzt werden können, um Behandlungserfolge schneller und präziser sichtbar zu machen – nicht nur für die Behandelnden, sondern auch für Patientinnen und Patienten“, sagt Vivek Venkataramani. Für die Betroffenen böten diese Geräte die Chance, mögliche körperliche Frühwarnzeichen kontinuierlich zu erfassen und selbstständig im Auge zu behalten. Der Mediziner, der Fallbeispiele wie diese regelmäßig in seinen Vorlesungen „Neues aus der Präzisionsonkologie“ bringt, plant, künftig auch tragbare Technologien, so genannte Wearables, in klinische und akademische Studien zu integrieren und zu evaluieren.
Barbara Deschler-Baier betont, dass der Fallbericht eine enorme Motivation für Forschende und Behandelnde sei, die personalisierte Diagnostik und Therapie weiter zu verfeinern und möglichst vielen Patientinnen und Patienten zugänglich zu machen: „Genveränderungen wie Fusionen im RET-Gen konnten gelegentlich die Ursache für die Entstehung verschiedener Krebsarten und bieten ideale Angriffspunkte für Präzisionsmedikamente, die gezielt Krebszellen bekämpfen und gesunde Zellen schonen. Fallberichte wie dieser zeigen das Potenzial einer hochmodernen, zielgerichteten Krebstherapie.“
Weiterentwicklung der Präzisionsonkologie
Weltweit und insbesondere in der Universitätsmedizin Würzburg mit dem CCC MF, dem Zentrum für Personalisierte Medizin (ZPM) einschließlich des Molekularen Tumorboards, der Interdisziplinären Studienambulanz (ISZ) und der Early Clinical Trial Unit (ECTU) sowie den Partnern in Erlangen, Regensburg und Augsburg im Rahmen der WERA-Allianz wird mit Hochdruck daran gearbeitet, die Genauigkeit und Wirksamkeit der Krebsbehandlung durch neue innovative Diagnostik und Therapien weiter zu verbessern und möglichst vielen Krebskranken zugänglich zu machen.
Wichtige Punkte sind dabei die Intensivierung der molekulargenetischen Testung und der Ausbau der molekulargenetischen Analysen. „In unserem interdisziplinären Expertengremium, dem Molekularen Tumorboard, werden jährlich rund 400 Patientenfälle vorgestellt“, berichtet Dr. Markus Krebs, Arzt im Molekularen Tumorboard am UKW. „Durch unsere enge Vernetzung mit den behandelnden Ärztinnen und Ärzten in der Region und die Kooperationen im CCC WERA und NCT WERA sowie den bayern- und bundesweiten Konsortien wie dem Bayerischen Zentrum für Krebsforschung (BZKF) und dem Nationalen Centrum für Tumorerkrankungen (NCT) steht die Präzisionsonkologie am UKW immer mehr Patientinnen und Patienten zur Verfügung.“
Publikation:
Deschler-Baier, B.*, Krebs, M* et al. Rapid response to selpercatinib in RET fusion positive pancreatic neuroendocrine carcinoma confirmed by smartwatch. npj Precis. Onc. 8, 167 (2024). https://doi.org/10.1038/s41698-024-00659-x * geteilte Erstautorenschaft
Text: Kirstin Linkamp / UKW