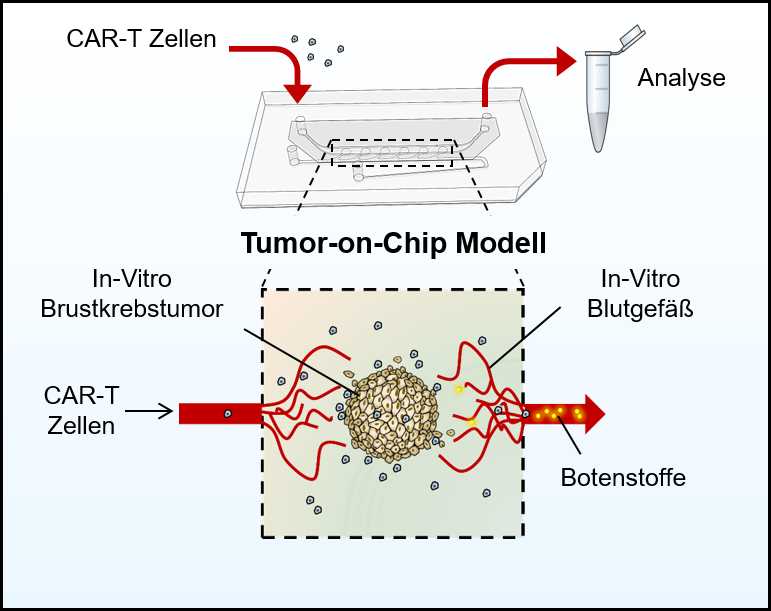
Röntgenmedaille für Anna-Leena Sirén und Georg Nagel
In Anerkennung ihrer herausragenden wissenschaftlichen Leistungen wurden Professorin Anna-Leena Sirén und Professor Georg Nagel auf dem Stiftungsfest 2024 mit Röntgen-Medaillen ausgezeichnet.
Die 1955 in Oulu, Finnland geborene Medizinerin Anna-Leena Sirén war von 2004 bis 2021 Professorin für Experimentelle Neurochirurgie an der Universität Würzburg und leitete dort die Sektion Experimentelle Neurochirurgie. Seit 2021 ist sie Seniorprofessorin am Physiologischen Institut. Ihre Forschungsschwerpunkte liegen in der translationalen Forschung an Mechanismen der Neuroprotektion und -regeneration nach Hirnverletzungen. Mit der Erforschung des Hormons Erythropoietin gelang ihr zusammen mit Kolleginnen und Kollegen vom Max-Planck-Institut für experimentelle Medizin die weltweit erste erfolgreiche neuroprotektive Behandlung bei Schlaganfall-Patienten.
Der 1953 in Weingarten geborene Biologe und Biophysiker Georg Nagel erhielt 2004 einen Ruf an die Julius-Maximilians-Universität Würzburg, wo er bis 2021 die Professur für Molekulare Pflanzenphysiologie innehatte. Seit 2021 ist er als Seniorprofessor am Physiologischen Institut der JMU aktiv. Den Schwerpunkt seiner Forschung legt Georg Nagel auf das Gebiet des Membrantransports und seiner molekularen Akteure, wobei sein Interesse dabei sowohl Vorgängen in Pflanzen als auch im Menschen gilt. Daneben sind natürlich und künstlich hergestellte Photorezeptoren und deren optogenetische Anwendung ein weiterer Fokus seiner wissenschaftlichen Arbeiten.
Weitere Informationen zu Anna-Leena Sirén und Georg Nagel finden Sie hier.
Verdienstmedaille für Esther Asan
Für ihre Verdienste um Gleichstellung und wissenschaftlichen Nachwuchs erhielt Professorin Esther Asan auf dem Stiftungsfest 2024 die Julius-Maximilians-Verdienstmedaille.
Neben ihren hochgeschätzten Beiträgen zu Forschung und Lehre hat die Medizinerin Esther Asan die Julius-Maximilians-Universität Würzburg über viele Jahre auf dem Gebiet der Gleichstellung und der Förderung des wissenschaftlichen Nachwuchses geprägt, gefordert und unterstützt. In ihren vielfältigen Rollen trug sie wesentlich zur Entwicklung der Universität bei und wurde weit über die Medizinische Fakultät hinaus zum Vorbild für viele.
Details zu Esther Asan und ihrem Wirken finden Sie hier.
Martin Lohse ist Ehrenbürger
Auf dem Stiftungsfest 2024 hat die Universität ihrem früheren Vizepräsidenten Martin Lohse für seine herausragenden Verdienste die Würde eines Ehrenbürgers verliehen.
Martin Lohse ist ein weltweit anerkannter Wissenschaftler, der bedeutende Beiträge in der Pharmakologie und Toxikologie geleistet hat. An der Universität Würzburg gründete und leitete er das Rudolf-Virchow-Zentrum und die Graduate Schools, förderte die Forschung an regulatorischen Membranproteinen und entwickelte zusammen mit Jörg Hacker das Konzept für die Max-Planck-Forschungsgruppe für Systemimmunologie an der Universität Würzburg. Seit 2020 ist er Geschäftsführer von ISAR Bioscience in München.
Weitere Informationen zu Martin Lohse finden Sie hier.
Preise für herausragende Dissertationen
Jedes Jahr werden beim Stiftungsfest der JMU herausragende Dissertationen ausgezeichnet, die sich thematisch mit Unterfranken befassen oder deren Autorinnen und Autoren seit längerer Zeit in der Region leben.
Die diesjährigen 19 Preisträgerinnen und Preisträger erhielten die mit 500 Euro dotierten Promotionspreise der Unterfränkischen Gedenkjahrstiftung für Wissenschaft und der Universität Würzburg von Unterfrankens Regierungsvizepräsident Jochen Lange und von JMU-Vizepräsidentin Caroline Kisker.
- Dr. Marvin Dippell: Constraint Reduction in Algebra, Geometry and Deformation Theory. Betreuung: Prof. Dr. Stefan Waldmann / Mathematik
- Dr. Jana Englmeier: Consequences of climate change and land-use intensification for decomposer communities and decomposition processes, Betreuung: Prof. Dr. Jörg Müller / Biologie
- Dr. Chiara Louisa Freichel: Analyse und Gestaltung digitaler Plattformen für Produktionsnetzwerke. Betreuung: Prof. Dr. Axel Winkelmann / Wirtschaftswissenschaften
- Dr. Eugen Gefel: Zelluläre Resorption 3D-gedruckter Knochenimplantate auf Basis von Calciummagnesiumphosphaten, Betreuung: apl. Prof. Dr. Uwe Gbureck / Medizin
- Dr. Maximilian Häberlein: Through a Whirlwind and Clouds: Text, Translation Technique, Literary and Theological Profile of Job 38:1-42:6 Old Greek. Betreuung: Prof. Dr. Barbara Schmitz / Katholische Theologie
- Dr. Tobias Thimo Helbig: Theory of eigenstate thermalization. Betreuung: Prof. Dr. Martin Greiter / Physik
- Dr. Lukas-Valentin Herm: Algorithmic Decision-Making Facilities: Perception and Design of Explainable AI-based Decision Support Systems. Betreuung: Prof. Dr. Christian Janiesch / Wirtschaftswissenschaften
- Dr. Marie-Theres Hess: Digitale Technologien und freie Beweiswürdigung – eine Untersuchung der Einflüsse von technologiegestützten Beweisen und Legal-TechAnwendungen auf die Sachverhaltsfeststellung im Strafprozess. Betreuung: Prof. Dr. Dr. Eric Hilgendorf / Jura
- Dr. Manuel Hoder: Wortgewandte Wappen. Inszenierungsformen des Heraldischen in der mittelalterlichen Literatur, Betreuung: Prof. Dr. Regina Toepfer / Germanistik
- Dr. Sinan David Kaya-Zeeb: Octopaminergic Signaling in the Honeybee Flight Muscles – A Requirement for Thermogenesis. Betreuung: Dr. Markus Thamm / Biologie
- Dr. Marius Daniel Müller: Die Notzuständigkeit im europäischen und deutschen Internationalen Zivilverfahrensrecht. Betreuung: Prof. Dr. Michael Sonnentag / Jura
- Dr. Carolin Scheitl: In vitro selected ribozymes for RNA methylation and labeling. Betreuung: Prof. Dr. Claudia Höbartner / Chemie
- Dr. Nina Schukraft: Integrated defensive states and their neuronal correlates in the Periaqueductal Gray. Betreuung: Prof. Dr. Philip Tovote / Graduate School of Life Sciences
- Dr. Miriam Schwebler: Sprachliches Place-Making. Eine sprachwissenschaftliche Analyse der diskursiven Konstruktion von Wissen über Raum. Betreuung: Prof. Dr. Matthias Schulz / Germanistik
- Dr. Daniel Alexander Solvie: Molecular Mechanisms of MYC as Stress Resilience Factor. Betreuung: Prof. Dr. Martin Eilers / Graduate School of Life Sciences
- Dr. Rudolf Raul Albert Stühler: Growth and Spectroscopy of the Two-dimensional Topological lnsulator Bismuthene on SiC(0001). Betreuung: Prof. Dr. Ralph Claessen / Physik
- Dr. Lukas Johannes Weiß: Platelet Function Analysis in Septic Patients. Betreuung: Prof. Dr. Harald Schulze / Medizin
- Dr. Ludwig Zapf: Novel Borane- and Phosphorane-Functionalized Anionic Carbene Ligands. Betreuung: Prof. Dr. Maik Finze / Chemie
- Dr. Johannes Zink: Algorithms for Drawing Graphs and Polylines with Straight-Line Segments. Betreuung: Prof. Dr. Alexander Wolff / Informatik
Pressemitteilung der Universität Würzburg, Meldung aus einBLICK vom 14.05.2024