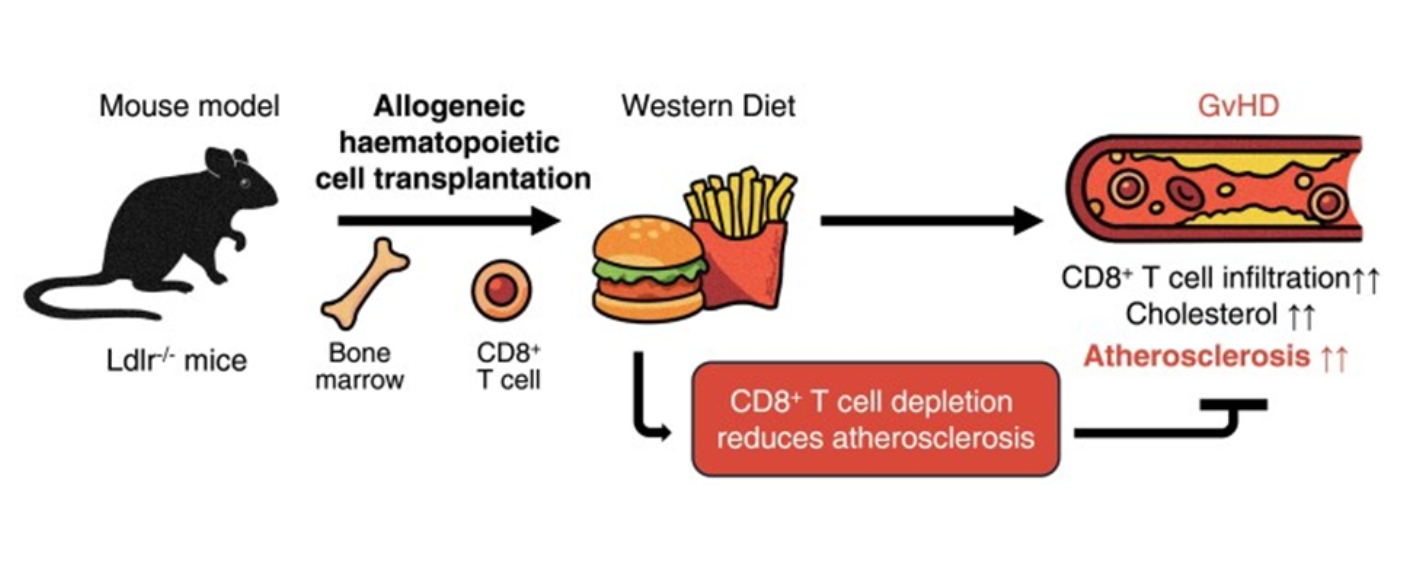
Genau das hat eine neue experimentelle Studie unter der Leitung von Prof. Dr. Dr. Andreas Beilhack und Prof. Dr. Alma Zernecke-Madsen untersucht.
In einem Mausmodell simulierten die Forschenden eine allogene Stammzelltransplantation mit einer leichten Form der Graft-versus-Host-Erkrankung (GvHD), bei der Immunzellen des Spenders den Körper des Empfängers angreifen. Die Tiere erhielten zusätzlich eine fettreiche westliche Ernährung, um Herz-Kreislauf-Risiken zu verstärken.
Das Ergebnis: Mäuse, die neben den Stammzellen auch Immunzellen (T-Zellen) vom Spender bekamen, entwickelten deutlich stärkere Ablagerungen in den Blutgefäßen als Vergleichstiere. Besonders auffällig war eine vermehrte Ansammlung bestimmter Immunzellen, sogenannter CD8-T-Zellen, in der Gefäßwand. Gleichzeitig waren bei diesen Tieren die Cholesterinwerte im Blut erhöht.
Wurden diese CD8-T-Zellen gezielt entfernt, nahmen sowohl die Gefäßverkalkung als auch die Cholesterinwerte deutlich ab. Das zeigt, dass diese Immunzellen eine zentrale Rolle bei der Schädigung der Gefäße spielen.
Publikation:
Ivana Jorgacevic, Haroon Shaikh, Hla Ali, Maja Bundalo, Sarah Schäfer, Michael A G Kern, Maike Büttner-Herold, Simone Reu-Hofer, Clément Cochain, Hendrik Bartolomaeus, Antoine-Emmanuel Saliba, Melanie Rösch, Giuseppe Rizzo, Estibaliz Arellano Viera, Juan Gamboa Vargas, Friederike Berberich-Siebelt, Wolfgang Herr, Louis Boon, Andreas Rosenwald, Elke Butt, Heike M Hermanns, Andreas Beilhack, Alma Zernecke. Allogeneic haematopoietic cell transplantation promotes atherosclerosis in mice via CD8+ T cells. Cardiovasc Res. 2025;121(17):2668-2678. https://doi.org/10.1093/cvr/cvaf229
Editorial zur Publikation:
Anton Gisterå, Hannes Lindahl, Graft vs. atheroma in a battle of host dominion, Cardiovascular Research, Volume 121, Issue 17, December 2025, Pages 2614–2615, https://doi.org/10.1093/cvr/cvaf266