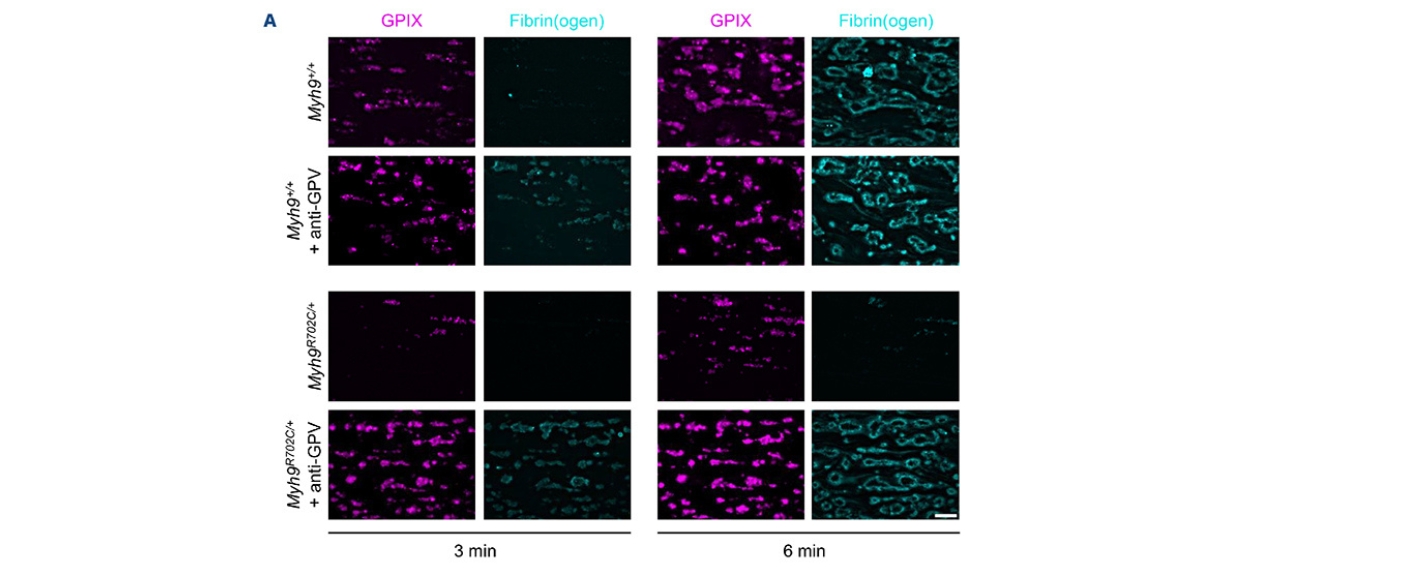
Die Erkrankung wird durch Mutationen im MYH9-Gen verursacht, die zu vergrößerten, funktionell eingeschränkten Blutplättchen (Thrombozyten) und einer erhöhten Blutungsneigung führen.
Bisherige Therapien zielen vor allem auf die Erhöhung der Thrombozytenzahl oder die Hemmung der Fibrinolyse ab. In dieser Arbeit präsentieren die Autoren eine alternative, Thrombozyten-spezifische, antikörperbasierte Therapieoption für die MYH9-assoziierte Erkrankung, mit der funktionelle Defizite der Hämostase gezielt korrigiert werden können. Aufbauend auf früheren Arbeiten zur Rolle des Thrombozytenrezeptors Glykoprotein V (GPV) untersuchten sie, ob die Blockade der Thrombin-vermittelten GPV-Spaltung die Hämostase verbessern kann.
In mehreren Mausmodellen der MYH9-Erkrankung führte die Hemmung der GPV-Spaltung zu einer beschleunigten und verstärkten Fibrinbildung unter Flussbedingungen sowie zu deutlich verkürzten Blutungszeiten in vivo. Bemerkenswert ist, dass dieser Effekt unabhängig von einer Erhöhung der Thrombozytenzahl auftrat.
Die Ergebnisse zeigen, dass die gezielte Modulation der GPV-Spaltung einen vielversprechenden, Thrombozyten-spezifischen Therapieansatz darstellt. Perspektivisch könnte dieser Ansatz nicht nur für erbliche Thrombozytenerkrankungen, sondern auch bei erworbenen Thrombozytenfunktionsstörungen klinisch relevant sein.
Publikation
Patricia Öftering, Juliane Baumann, Sarah Beck, Andreas Greinacher, Bernhard Nieswandt, Markus Bender. Blocking platelet glycoprotein V cleavage reduces bleeding in mouse models of MYH9-related disease. Haematologica. 2025 Dec 1;110(12):3099-3103.
doi: 10.3324/haematol.2025.287542