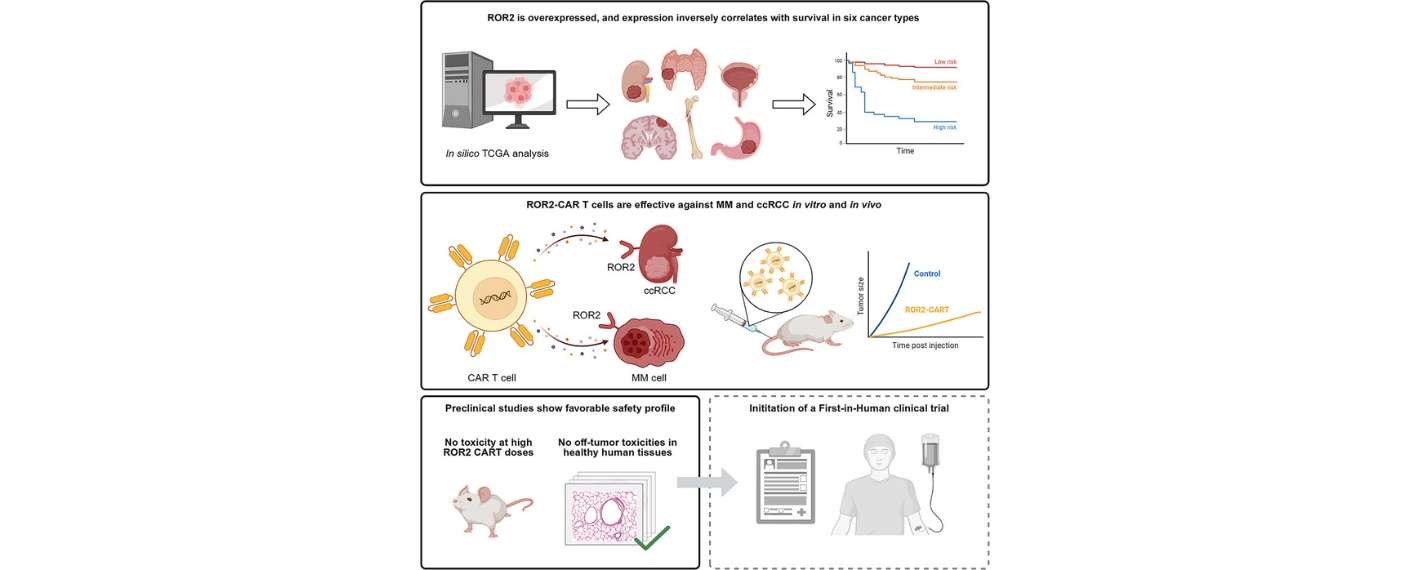
In einer aktuellen Studie, veröffentlicht in Cell Reports Medicine (Cell Press), hat ein UKW-Team gemeinsam mit weiteren Partnern öffentliche Genexpressionsdaten untersucht. Dabei zeigte sich, dass hohe ROR2-Werte bei sechs verschiedenen Krebsarten, darunter Gehirn-, Schilddrüsen-, Magen-, Blasen- und Nierenkrebs, mit einer verkürzten Überlebenszeit der Patienten und Patientinnen zusammenhängen.
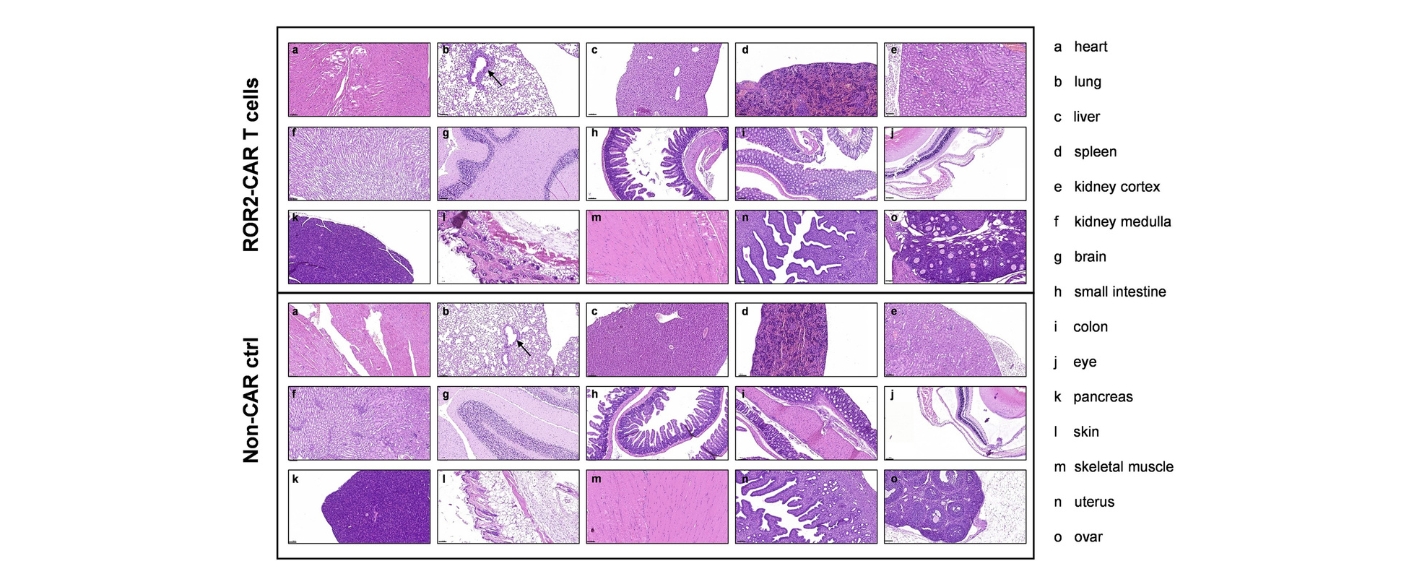
Auf Grundlage dieser Erkenntnisse entwickelte das Forschungsteam ROR2-spezifische CAR-T-Zellen, die in präklinischen Modellen hohe Wirksamkeit gegen das Multiple Myelom zeigten. Auch bei Nierenkrebs erwiesen sich die ROR2-CAR-T-Zellen in vitro und in vivo als effektiv, ohne dabei gesundes Gewebe anzugreifen.
Diese Ergebnisse bestätigen ROR2 als innovatives und sicheres Ziel für die CAR-T-Zelltherapie. Eine erste klinische Studie am Menschen mit ROR2-CAR-T-Zellen ist bereits in Vorbereitung und soll Anfang 2026 starten.
Publikation:
Justus Weber, Michael Rade, Josefine Michael, Liz Therese Tony, Fabian Freitag, Peter Spieler, Claudia Müller, Charis Kalogirou, Laura Mainz, Jörg Lehmann, Robert Klopfleisch, Mathias T. Rosenfeldt, Sophia Danhof, K. Martin Kortüm, Ulrike Köhl, Hermann Einsele, Christoph Rader, Kristin Reiche, Thomas Nerreter, Michael Hudecek. ROR2-specific CAR T cells are effective against hematologic and solid tumors and well tolerated in mice. Cell Reports Medicine, October 21, 2025. doi: 10.3389/fimmu.2025.1601670
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(25)00473-2