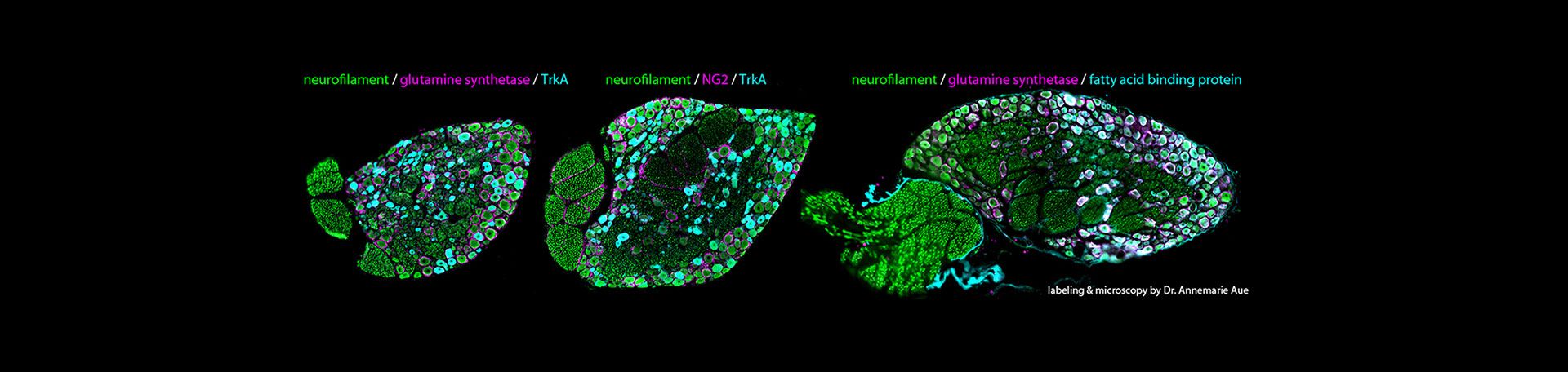
In diesem Projekt untersuchen wir die molekularen und zellulären Mechanismen der natürlichen Schmerzauflösung. Insbesondere soll die Rolle von Subtypen lokaler Makrophagen und Satelliten-Gliazellen (SGC) identifiziert werden, die nach einer Nervenverletzung maßgeblich an der Schmerzauflösung beteiligt sind. Durch die Untersuchung dieser Zelltypen in Tiermodellen und bei Patienten möchten wir besser verstehen, wie der Heilungsprozess auf zellulärer Ebene verläuft und wie Makrophagen und SGCs interagieren, um die Schmerzauflösung zu steuern.
Hintergrund
Neuropathischer Schmerz, der häufig durch Nervenverletzungen verursacht wird, kann bei einigen Patienten zu langanhaltenden Schmerzen führen. Allerdings tritt in manchen Fällen eine natürliche Schmerzauflösung ein, deren Mechanismen bislang nur unzureichend verstanden sind. Frühere Studien haben die Rolle von sensorischen Neuronen, Gliazellen und Makrophagen bei der Entstehung neuropathischer Schmerzen identifiziert. Wenig bekannt ist jedoch, wie diese Zellen zur Schmerzauflösung beitragen. Insbesondere Makrophagen an der Schnittstelle von Neuronen und Gliazellen scheinen eine wichtige Rolle bei der Modulation von Schmerzreaktionen zu spielen. Zudem besteht ein möglicher Zusammenhang zwischen den Makrophagen im Spinalganglion (DRG) und Monozyten/Makrophagen im Blut, was neue Einblicke in chronische Schmerzsyndrome wie das Complex Regional Pain Syndrome (CRPS) liefern könnte.
Forschungsziel
Das Projekt verfolgt folgende Ziele:
- Identifizierung der zellulären Phänotypen lokaler Makrophagen und SGCs im DRG, die während der Schmerzauflösung wichtige Signalmoleküle produzieren.
- Untersuchung der transkriptionellen Umprogrammierung von SGCs und DRG-Makrophagen während der Schmerzauflösung, mit besonderem Fokus auf geschlechtsspezifische Unterschiede.
- Isolation und Kategorisierung von Monozyten-Subtypen aus dem Blut von Ratten mit neuropathischen Schmerzen und CRPS-Patienten, um Korrelationen mit den Makrophagen-Phänotypen im DRG herzustellen.
- Modellierung der multizellulären Mechanismen der Schmerzauflösung durch Untersuchung der dynamischen Interaktion zwischen Makrophagen, sensorischen Neuronen und SGCs in einem 3D-Zellkultursystem.
Bedeutung
Ein besseres Verständnis der Rolle von Makrophagen und SGCs bei der Schmerzauflösung wird nicht nur unser Wissen über die biologischen Mechanismen neuropathischer Schmerzen erweitern, sondern könnte auch neue therapeutische Zielstrukturen für chronische Schmerzsyndrome wie CRPS aufzeigen. Der Vergleich zwischen neuropathischen Schmerzen in Rattenmodellen und CRPS-Patienten ermöglicht es, die Brücke zwischen Grundlagenforschung und klinischer Anwendung zu schlagen und damit potenziell neue Behandlungsansätze zu entwickeln.
Forschungsteam NP9
Leitung
Prof. Dr. rer. nat. Robert Blum
Neurologische Klinik und Poliklinik
Universitätsklinikum Würzburg
Prof. Dr. med. Alexander Brack
Stellvertretender Klinikdirektor der Klinik für Anästhesiologie, Intensivmedizin, Notfallmedizin und Schmerztherapie
Universitätsklinikum Würzburg
Mitarbeiterinnen und Mitarbeiter im Team
Dr. rer. nat. Annemarie Sodmann, wissenschaftliche Mitarbeiterin
Felicitas Schlott, Doktorandin
Niels Köhler, Doktorand