Würzburg. Das Glioblastom ist der aggressivste bösartige Hirntumor bei Erwachsenen und eine der herausforderndsten Krebserkrankungen der Neurologie und Neurochirurgie. Denn Glioblastome wachsen schnell und infiltrieren das umliegende Hirngewebe, was eine vollständige chirurgische Entfernung nahezu unmöglich macht. Zudem sind diese Tumoren sehr resistent gegen Therapeutika. Glioblastome sind bisher nicht heilbar. Die mittlere Überlebenszeit nach Diagnosestellung beträgt etwa 18 Monate.
Um zu verstehen, warum beispielsweise Chemotherapeutika nicht wirken und wie diese Resistenzen überwunden werden können, entwickelte die Klinische Neurobiologie des Universitätsklinikums Würzburg (UKW) ein translationales 3D-Zellkultursystem, an dem die Interaktionen von Hirntumorzellen (Glioblastom) mit gesunden Gehirnzellen untersucht werden können. Das 3D-Modell basiert auf Neuronen (Nervenzellen), Astrozyten (spezialisierte Gliazellen des zentralen Nervensystems) und Tumorzellen der Maus.
Mechanismen des Tumorwachstums und dessen Eindämmung besser verstehen
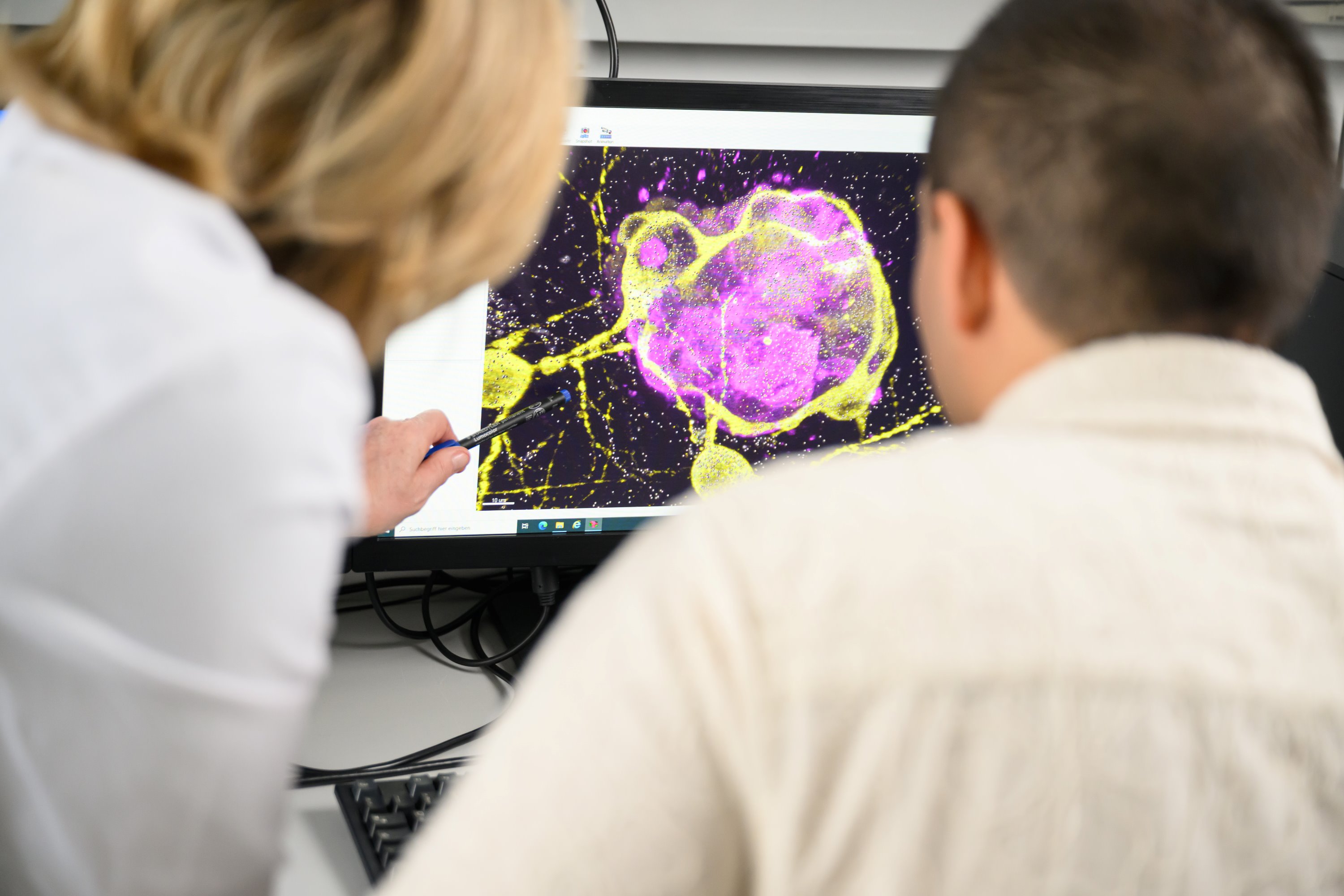
„Wir konnten zeigen, dass dieses Glioblastom-Modell die Mikroumgebung des Tumors und die Zell-Zell-Interaktionen, wie wir sie von in vivo Xenograft-Modellen kennen, sehr gut simuliert. Das heißt, unser 3D-Modell bildet die natürliche Umgebung und die Wechselwirkungen zwischen den Zellen realistisch ab, ähnlich wie bei Experimenten mit lebenden Organismen. Mit dem Modell können wir Chemotherapeutika und deren Wirkmechanismus auf das Tumorwachstum untersuchen und manipulieren“, erklärt Mateo S. Andrade Mier. Der Doktorand veröffentlichte sein Forschungsprojekt jetzt als Erstautor in der Fachzeitschrift Advanced Functional Materials.
Prof. Dr. Carmen Villmann, Arbeitsgruppenleiterin am Institut für Klinische Neurobiologie, erläutert die Relevanz: „Mit der Etablierung eines 3D-Zellkulturmodells, das ähnliche Eigenschaften wie die in vivo Situation aufweist, haben wir einen wichtigen Baustein für die translationale Forschung geliefert, um die Mechanismen des Tumorwachstums und dessen Eindämmung besser zu verstehen.“
Spezielle Gerüste aus Mikrofasern wurden mit verschiedenen Zelltypen besiedelt
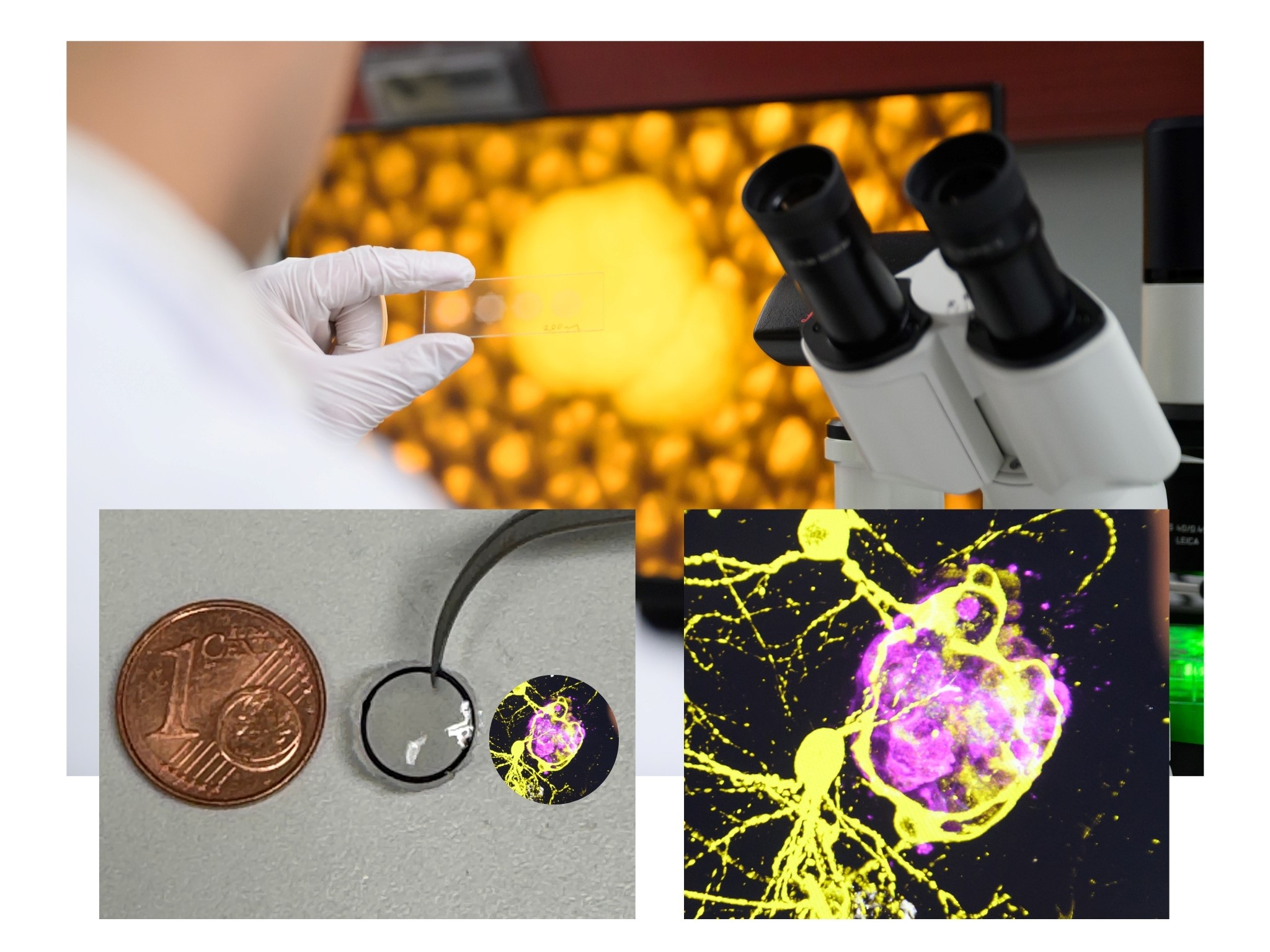
Auch wenn 3D hier einfach klingt, war das Druckverfahren aufgrund der Ultraweichheit des natürlichen Hirngewebes eine Herausforderung für sich, so Carmen Villmann. Denn derartige ultraweiche Biotinten oder Hydrogele würden sich wie Wasser an der Oberfläche ausbreiten und ließen sich nur schwer formen (siehe Info-Kasten). Um dieses Problem zu lösen, verwendete das interdisziplinäre Team zur Verstärkung des Modells spezielle Gerüste aus Mikrofasern, die mittels Biofabrikation in verschiedenen Formen gedruckt werden können und biokompatibel sind. Die Gerüste wurden mit verschiedenen Zelltypen besiedelt, was Langzeitstudien über mehrere Wochen ermöglichte.
In einem nächsten Schritt soll das 3D-Modell des Glioblastoms in ein rein humanes Modell unter Verwendung von induzierten pluripotenten Stammzellen, humanen Astrozyten, Mikrogliazellen und humanen Glioblastomzellen überführt werden. Dieses Modell kann dann verwendet werden, um die Resistenz dieser Tumoren gegenüber Therapeutika weiter zu untersuchen.
Sonderforschungsbereich SFB TRR 225: Von den Grundlagen der Biofabrikation zu funktionalen Gewebemodellen
Das Projekt ist Teil des von der Deutschen Forschungsgemeinschaft (DFG) geförderten Sonderforschungsbereichs SFB TRR 225 „Von den Grundlagen der Biofabrikation zu funktionalen Gewebemodellen“, in dem Teams aus der Universitätsmedizin in Würzburg, Erlangen und Bayreuth Material-, Grundlagen- und klinische Wissenschaften zusammenführen. Ziel ist es, eigene Hydrogele zu entwickeln und zu charakterisieren sowie mit neuen Methoden Gewebemodelle zu etablieren, die für translationale Ansätze genutzt werden können. Für das 3D-System erstellten PD Dr. Jörg Tessmar und seine Arbeitsgruppe vom Würzburger Lehrstuhl für Funktionswerkstoffe der Medizin und der Zahnheilkunde (FMZ) das Hydrogel, welche auf Hyaluronsäure basiert, einer wesentlichen Komponente der extrazellulären Matrix im Gehirn. Die Physikerin Prof. Dr. Katrin Heinze und ihr Team vom Rudolf-Virchow-Zentrum (RVZ) trugen mit ihren exzellenten bildgebenden Möglichkeiten wesentlich zur Charakterisierung der Zell-Matrix und Zell-Zell-Interaktionen bei. Prof. Dr. Silvia Budday von der Friedrich-Alexander-Universität Erlangen-Nürnberg (FAU) übernahm zusammen mit Dr. Gregor Lang vom FMZ die wesentlichen Untersuchungen auf der Seite der Biomaterialien und der Biofabrikation.
Was ist 3D-Bioprinting
3D-Bioprinting ist eine innovative Technologie, bei der lebende Zellen mit Hilfe spezieller Biotinten und Hydrogele in präzise Gewebestrukturen gedruckt werden. So bieten Hydrogele mit ihren wasserreichen Polymeren eine ideale biochemische Umgebung, die das Zellwachstum fördert. Biotinten sind eine Mischung aus lebenden Zellen und Hydrogel-Materialien. Sie müssen flüssig genug sein, um durch die Druckdüse zu fließen, aber nach dem Druck stabil bleiben. In der medizinischen Forschung wird 3D-Bioprinting eingesetzt, um realistische Modelle menschlicher Gewebe und Organe für Medikamententests, Krankheitsstudien und regenerative Therapien herzustellen. Insbesondere in der Krebsforschung ermöglicht 3D-Bioprinting die Nachbildung der Tumormikroumgebung, um personalisierte Therapieansätze zu entwickeln. Die Technologie bietet eine vielversprechende Alternative zu Tierversuchen und klassischen Zellkulturen, da sie biologisch relevantere Ergebnisse liefert.
Publikation
Mateo S. Andrade Mier, Esra Türker, Jessica Faber, Mike Friedrich, Zan Lamberger, Jeannette Weigelt, Panthipa Suwannakot, Benedikt Gantert, Abhinav Singh, Vanessa Moessler, Annemarie Sodmann, Nicoletta Murenu, Joachim Schenk, Natascha Schaefer, Torsten Blunk, Aldo R. Boccaccini, Tessa C. Lühmann, Jörg Tessmar, Jeremy M. Crook, Eva Tomaskovic-Crook, Paul D. Dalton, Gregor Lang, Robert Blum, Reiner Strick, Silvia Budday, Katrin G. Heinze, Carmen Villmann. 3D In Vitro Glioma-Neuron-Astrocyte Biomimetic Composites Recapitulate Key Molecular Mechanisms Linked to Glioblastoma Multiforme Pathophysiology. Advanced Functional Materials. First published: 23 January 2025, doi.org/10.1002/adfm.202419211
Text: KL / Wissenschaftsredaktion