Fremde Substanzen, wie beispielsweise Feinstaub (PM) und Ultrafeinstaub (UFP), die unter anderem bei Verbrennungsprozessen in Flugzeugen und Dieselmotoren entstehen, können solche Störungen unter Umständen begünstigen. Wie das genau funktioniert, ist aber weitgehend unbekannt.
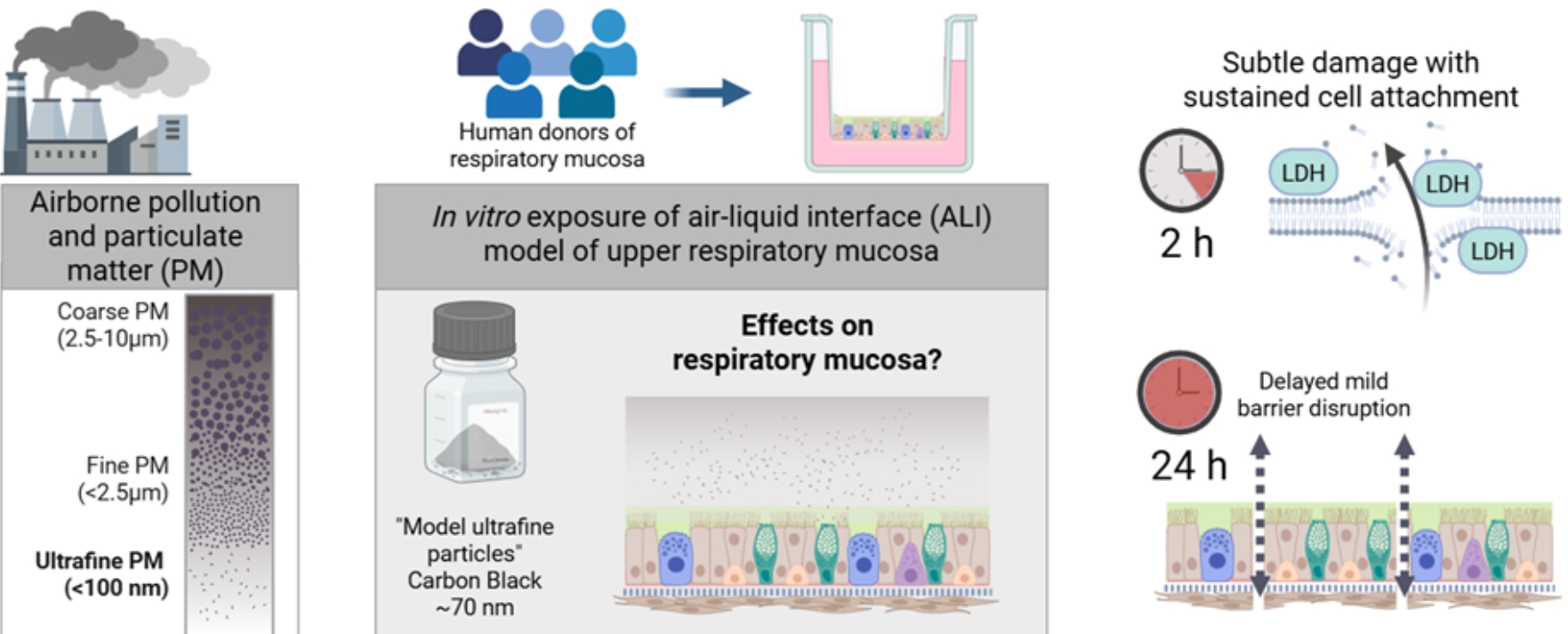
Um diesen Fragen nachzugehen, wurden im Rahmen des vom Bayerischen Staatsministerium für Umwelt und Verbraucherschutz finanzierten Projekts BayUFP Gewebemodelle der Nasenschleimhaut aus menschlichen Primärzellen hergestellt. Die Modelle werden von unten mit Zellkulturmedium versorgt, während die dem Epithel in der Nase entsprechende Oberfläche mit der Umgebungsluft in Kontakt steht. Die Modelle wachsen mehrere Wochen im Labor, bis sie die notwendigen, sehr realistischen Charakteristika der Nasenschleimhaut aufweisen, wie beispielsweise schlagende Kinozilien und Schleimproduktion. Anschließend wurden diese Modelle mit Carbon-Partikeln (~70 nm Carbon Black) behandelt.
Das Forschungsteam der HNO-Klinik konnte kurz nach der Exposition mit Carbon Black (2 Stunden) statistisch signifikante Effekte, die auf Zellschäden hindeuten, nachweisen. Aus biologischer Perspektive waren die Schäden jedoch nicht als zytotoxisch einzustufen. 24 Stunden nach der Exposition war die epitheliale Barriere noch intakt, jedoch messbar niedriger als in der unbehandelten Kontrollgruppe. Dies deutet darauf hin, dass die Barriere gestört ist und eventuell durchlässiger geworden ist, wodurch die Schutzfunktion der Nasenschleimhaut beeinträchtigt sein kann. Um mehr zu erfahren, wären Langzeitstudien und Mehrfach-Expositionen geeignet. Eine relevante Frage hierbei wäre, ob eine Exposition mit Carbon Black oder anderen ultrafeinen Partikeln (UFP) Infektionen oder chronische bzw. allergische Erkrankungen begünstigen kann.
In der aktuellen Publikation ist es dem Team aus der HNO gemeinsam mit Projektpartnern (Oppmann und Dembski vom Fraunhofer ISC, Würzburg und Delaval, Di Bucchianico und Zimmermann im Comprehensive Molecular Analytics (CMA)-Labor, Helmholtz Zentrum München) gelungen ein realitätsnahes Test- und Expositionssystem für solche Fragestellungen zu etablieren.
Totta Ehret Kasemo, Maximilian Oppmann, Sofia Dembski, Maria Steinke, Elena Lajtha, Helena Moratin, Manuel Stöth, Agmal Scherzad, Mathilde Noémie Delaval, Ralf Zimmermann, Sebastiano Di Bucchianico, Stephan Hackenberg, Till J. Meyer. High concentrations of Printex 90 carbon black ultrafine particles disturb the epithelial barrier in human primary respiratory mucosa models, Environmental Toxicology and Pharmacology, Volume 119, 2025, 104829, ISSN 1382-6689, https://doi.org/10.1016/j.etap.2025.104829.