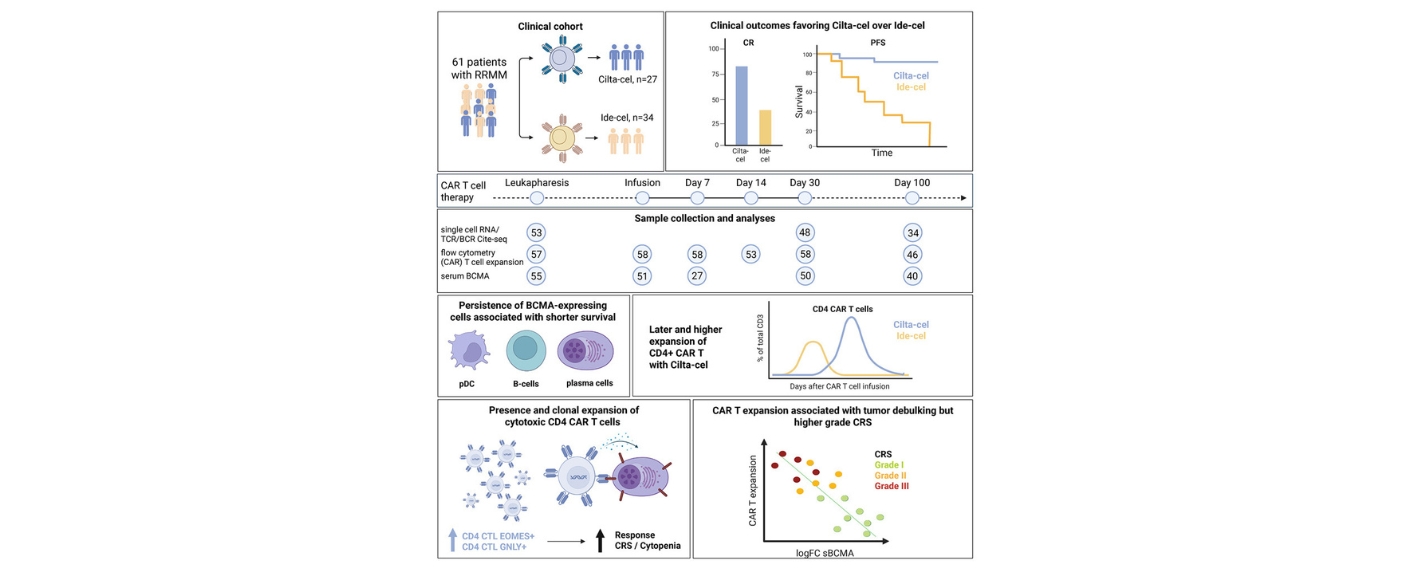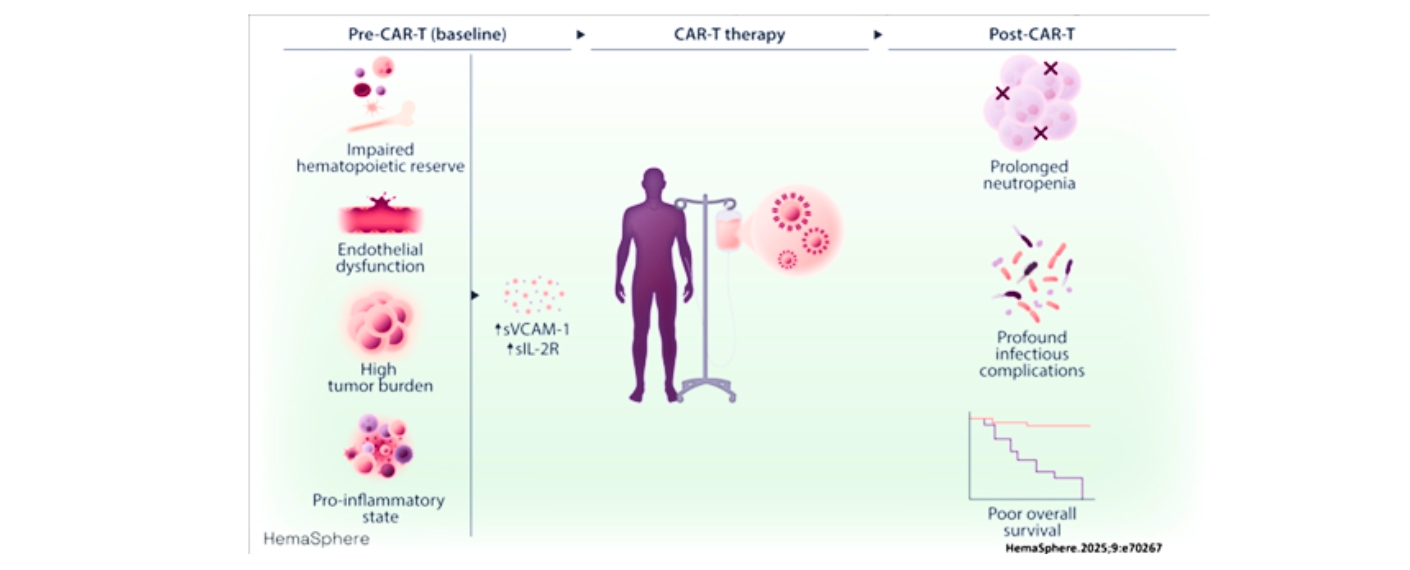
In einer Studie des UKW, des Fraunhofer-Instituts für Zelltherapie und Immunologie IZI und des Universitätsklinikums Leipzig wurden 78 Patienten vor und kurz nach der CAR-T-Infusion untersucht, um Biomarker zu finden, die solche Risiken vorhersagen können. Diese wurde im Fachjournal Hemasphere veröffentlicht.
Es zeigte sich, dass eine gestörte Funktion des Gefäßsystems (Endothel) und ein überaktiviertes Immunsystem besonders wichtige Risikofaktoren sind. Patientinnen und Patienten mit erhöhten Werten der Marker sVCAM-1 und sIL-2R vor der Therapie hatten eine schlechtere Überlebensrate, eine verzögerte Erholung der weißen Blutkörperchen, häufiger schwere Infektionen und die CAR-T-Zellen vermehrten sich im Körper weniger gut. Die Ergebnisse zeigen, dass diese beiden Marker unabhängig von anderen klinischen Faktoren genutzt werden können, um das Risiko für Komplikationen besser einzuschätzen.
Die Studie ist Teil der Arbeit des europäischen IMI imSAVAR-Konsortiums und bringt das Team einen Schritt näher daran, die Sicherheit neuer Immuntherapien weiter zu verbessern.
Publikation:
Scheller L, Zhou X, Loeffler-Wirth H, Kreuz M, Kadel SK, Schimanski S, Schulze H, Ruckdeschel A, Eisele F, Konetzki V, Jornet Culubret M, Merz M, Mersi J, Waldschmidt J, Danhof S, Köhl U, Kortüm KM, Rasche L, Einsele H, Düll J, Topp MS, Hudecek M, Reiche K, Alb M. Endothelial dysfunction and proinflammatory state determine severe hematotoxicity and inferior outcome of CAR-T therapy. Hemasphere. 2025 Dec 8;9(12):e70267. doi: 10.1002/hem3.70267. PMID: 41368079; PMCID: PMC12684805.
Zur Publikation