Die neue interdisziplinäre translationale Studie aus der klinischen Forschungsgruppe KFO5001 entstand in Zusammenarbeit des ZIS mit den Kliniken Med II und Neurologie sowie der Core Unit Systemmedizin und unsere Kooperationspartner und Kooperationspartnerinnen aus Berlin und Leipzig. Sie zeigt erstmals, dass frühe bortezomibinduzierte Neuropathie vor allem auf eine vorübergehende Störung der Blut-Nerven-Schranke und eine damit verbundene axonale Schädigung zurückgeht, während die Zellkörper der sensiblen Neurone in den Spinalganglien weitgehend intakt bleiben.
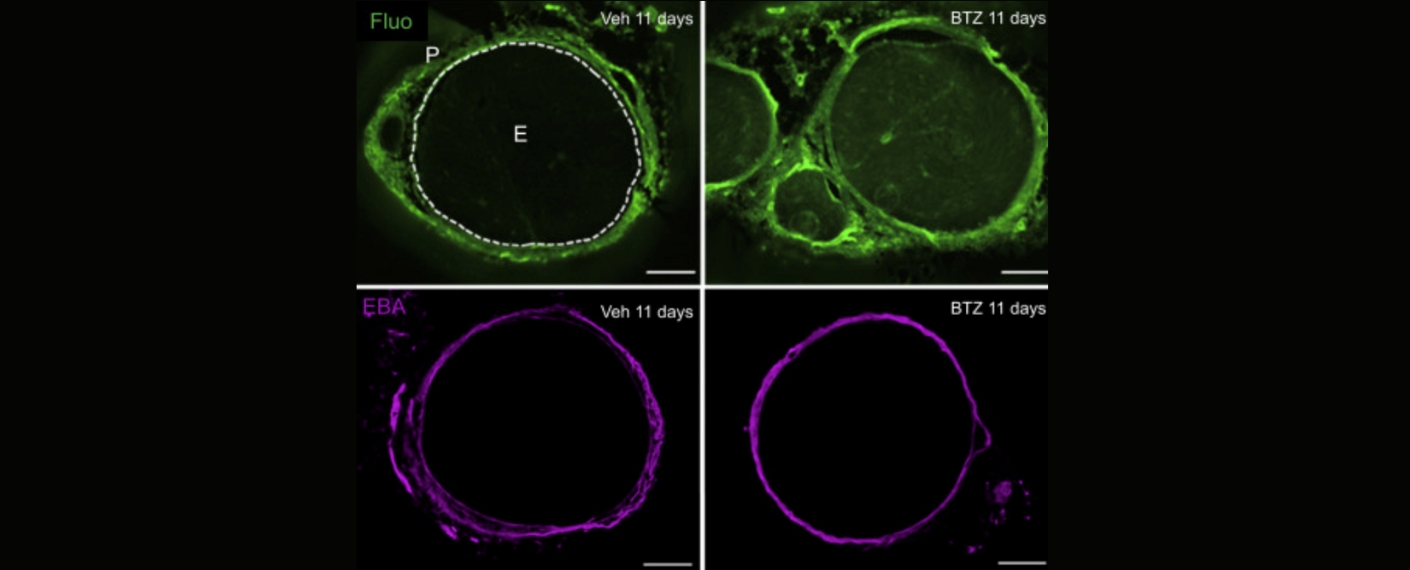
In einem Rattenmodell entwickelten die Tiere nach einem einzigen Bortezomib-Zyklus eine ausgeprägte Kälte- und Berührungsschmerzhaftigkeit, eine erhöhte Permeabilität des Perineuriums, axonale Schwellungen und einen Verlust epidermaler Nervenfasern; diese Veränderungen bildeten sich jedoch parallel zur funktionellen Erholung wieder zurück.
Auf molekularer Ebene waren die transkriptomischen Veränderungen in den Spinalganglien überraschend gering, wohingegen im peripheren Nerv vor allem zytoskelettassoziierte, zirkadiane, extrazelluläre-Matrix- und Immunwege reguliert wurden – begleitet von einer verstärkten Expression des Barriere- und Wachstumsfaktors Netrin‑1 in Nerv und Haut. Bei Myelompatienten und Myelompatientinnen mit schmerzhafter Bortezomib-induzierter Polyneuropathie bestätigte sich eine deutliche Reduktion der intraepidermalen Nervenfaserdichte, während Netrin‑1 in der Haut nicht erhöht war, was auf eine unzureichende endogene Reparaturantwort bei chronischen Verläufen hinweist.
Diese Arbeit setzt damit einen wichtigen Meilenstein in der Schmerzmedizin, Onkologie und Neurologie: Sie verschiebt das Verständnis der Bortezomib-Neurotoxizität hin zu einem barrierezentrierten Krankheitsmodell des peripheren Nervs und eröffnet neue, krankheitsmodifizierende Therapieansätze, die gezielt die Blut-Nerven-Schranke, die Extrazellulärmatrix und neuroimmune Signalwege stärken, um Chemotherapie-induzierte Polyneuropathien besser verhindern und behandeln zu können.
Publikation:
Mariam Sobhy Atalla, Anna-Lena Bettenhausen, Julius M. Verse, Nadine Cebulla, Susanne M. Krug, Reine-Solange Sauer, Mugdha Srivastava, Thorsten Bischler, Jeremy T.C. Chen, K. Martin Kortüm, Robert J. Kittel, Claudia Sommer, Heike L. Rittner. Neuronal toxicity and recovery from early bortezomib-induced neuropathy: blood-nerve barrier dysfunction without dorsal root ganglion damage. British Journal of Anaesthesia. 2025, ISSN 0007-0912, https://doi.org/10.1016/j.bja.2025.05.046.