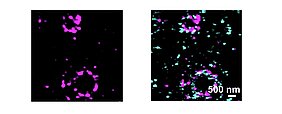
Die Forschungsgruppe von Michael Sendtner untersuchte die Rolle des SMN-Proteins beim axonalen Transport von Boten-RNA (mRNA). Dieser Transport ermöglicht die Produktion von Proteinen für Synapsen in den Endabschnitten der Nervenzellfortsätze und stellt somit die Erregungsübertragung von den motorischen Nervenzellen zu den Muskelfasern sicher. Insbesondere die Produktion des Munc13-1-Proteins in den präsynaptischen Terminalen ist bei der spinalen Muskelatrophie massiv gestört, da die entsprechende mRNA nicht in die Axone transportiert wird. Das Munc13-1-Protein ist für die Signalübertragung an den Kontaktstellen zwischen Nerven und Muskeln (Synapsen) entscheidend.
Dies kann korrigiert werden, indem die 3′-UTR-Region der Munc13-1-mRNA durch die des Synaptophysin-1-Transkripts ausgetauscht wird, dessen Transport bei spinaler Muskelatrophie nicht beeinträchtigt ist. So können die Funktion und die Ultrastruktur präsynaptischer Terminale, die mithilfe hochauflösender lichtmikroskopischer Verfahren in Zusammenarbeit mit der Arbeitsgruppe von Markus Sauer am Institut für Biotechnologie und Biophysik der Universität Würzburg am Hubland erstmals dargestellt werden konnten, wiederhergestellt werden.
Mehri Moradi, Julia Weingart, Chunchu Deng, Mahoor Nasouti, Michael Briese, Sibylle Jablonka, Markus Sauer, Michael Sendtner. Munc13-1 restoration mitigates presynaptic pathology in spinal muscular atrophy. Nat Commun 16, 8724 (2025). https://doi.org/10.1038/s41467-025-64164-w