Forscherinnen und Forscher der Klinik und Poliklinik für Dermatologie, Venerologie und Allergologie haben nun einen vielversprechenden Ansatz gefunden, um dieses widerstandsfähige Bakterium zu bekämpfen.
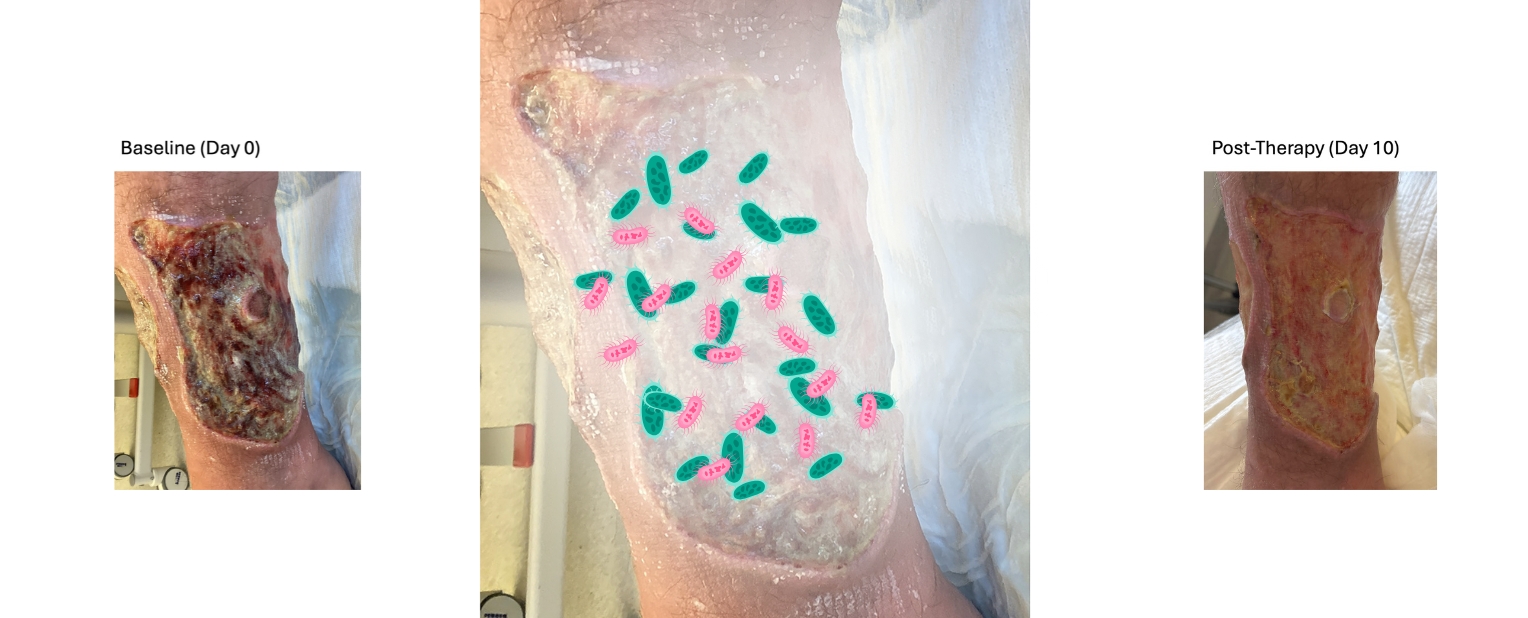
Zwei ältere Patientinnen und Patienten mit lang bestehenden, infizierten Wunden wurden zusätzlich zur Standardbehandlung mit einem Lactobacillus-haltigen Pulver behandelt. Bereits nach wenigen Tagen verbesserten sich Geruch und Belag der Wunden deutlich, und nach ein bis zwei Wochen zeigte sich neues, gesundes Gewebe. In Kontrollabstrichen war Pseudomonas aeruginosa nicht mehr nachweisbar. Die Behandlung wurde gut vertragen, Nebenwirkungen traten nicht auf. Auch bei weiteren Patientinnen und Patienten konnten ähnliche Verbesserungen beobachtet werden.
„Milchsäurebakterien können schädliche Keime wie Pseudomonas aeruginosa schwächen, indem sie deren Biofilme stören, Entzündungen reduzieren und Zellen der Wundheilung aktivieren“, erklärt Dr. Tassilo Dege, Erstautor der im Journal of the American Academy of Dermatology veröffentlichten Fallbeobachtung.
Labormodelle mit menschlicher Haut bestätigten diese Ergebnisse: Lactobazillen schwächen den Biofilm der Pseudomonas-Bakterien, stören deren Kommunikation und fördern gleichzeitig die Aktivität von Keratinozyten und Fibroblasten – zentrale Zellen der Wundheilung. Auch in Tierversuchen konnte gezeigt werden, dass Stoffwechselprodukte der Lactobazillen die Bakterienzahl und Entzündung in der Wunde reduzieren.
Die Anwendung probiotischer Bakterien könnte sich also künftig als wirksame und sichere Ergänzung in der Behandlung chronischer Wunden etablieren – ein Schritt hin zu einer heilungsfördernden, resistenzfreien Therapie.
Weitere klinische Studien sollen nun klären, wie sich dieser innovative Ansatz in der Praxis bewährt.
Details zum Fallbeispiel liefert die Pressemeldung.
Publikation: Tassilo Dege, Andreas Kerstan, Matthias Goebeler, Astrid Schmieder. Clinical pearl: Topical Lactobacillus application to disrupt Pseudomonas aeruginosa biofilms and promote healing in chronic wounds, Journal of the American Academy of Dermatology, 2025, ISSN 0190-9622, https://doi.org/10.1016/j.jaad.2025.12.071