Viele Betroffene entwickeln zusätzlich eine ausgeprägte Beeinträchtigung der Alltagsfunktion und der Lebensqualität, sodass CRPS zu den belastendsten Schmerzerkrankungen überhaupt zählt.
Im Zentrum für interdisziplinäre Schmerzmedizin (ZiS) werden Patientinnen und Patienten mit CRPS behandelt und in der klinischen Forschungsgruppe KFO5001 interdisziplinär und international erforscht.
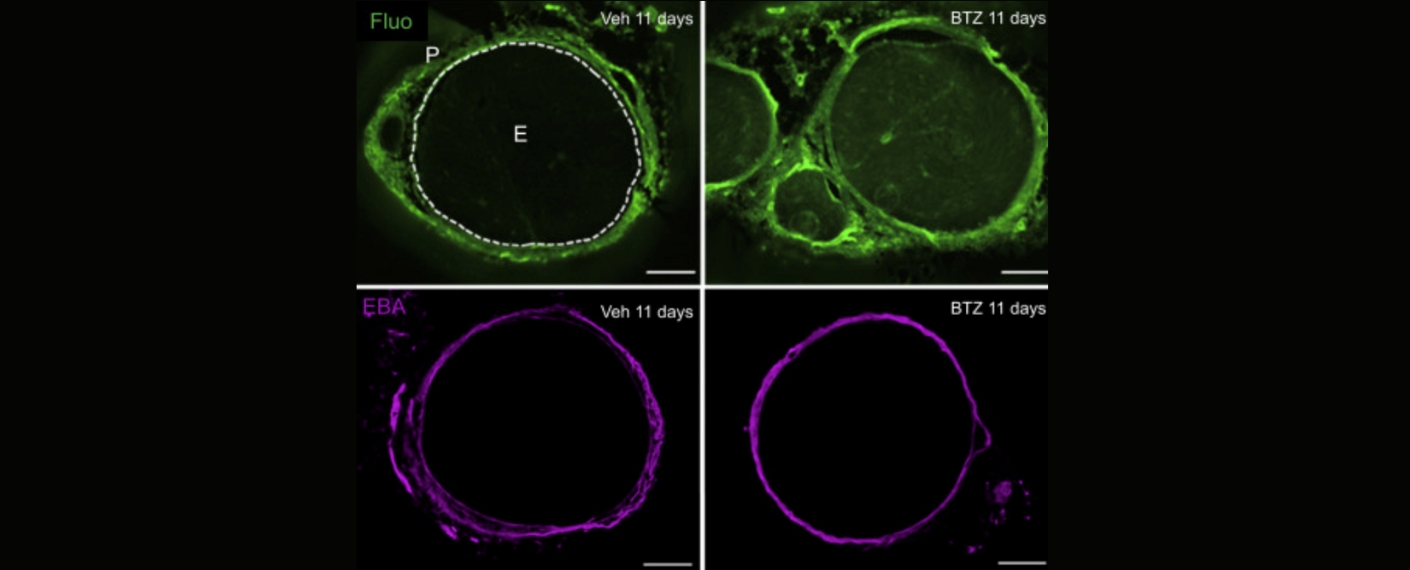
In dieser Studie wurden Patientinnen und Patienten mit akuten CRPS-Beschwerden (unter 12 Monaten) mit Personen mit chronischem CRPS (über 12 Monate) anhand von Schmerztests und funktioneller MRT im Ruhezustand verglichen. Denn CRPS geht nicht nur mit körperlichen Symptomen der Arme oder Beine einher, sondern verändert auch die Aktivität des Gehirns.
Es zeigte sich, dass Patientinnen und Patienten mit chronischem CRPS empfindlicher auf Druckschmerz reagierten als Betroffene mit akutem CRPS. Gleichzeitig war die Spontanaktivität im Nucleus accumbens bei chronischem CRPS deutlich verlangsamt. Dabei handelt es sich um eine Hirnstruktur, die bereits aus anderen chronischen Schmerzsyndromen als wichtiger Schaltknoten für die Schmerzchronifizierung bekannt ist.
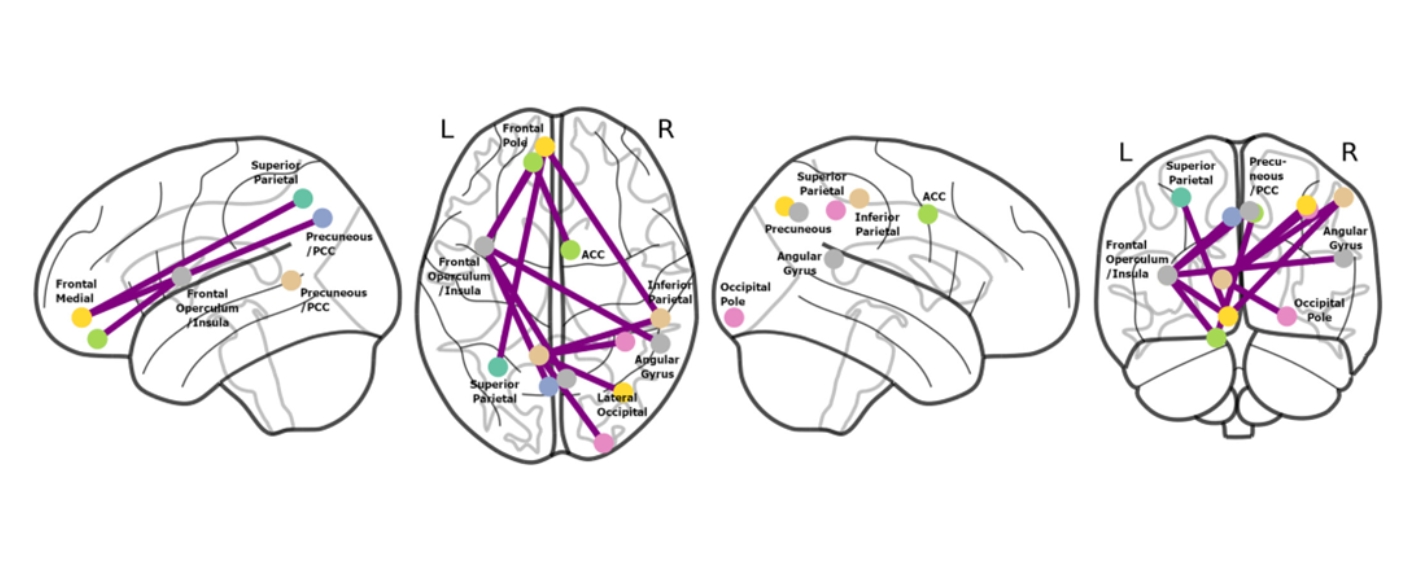
Dieses veränderte Aktivitätsmuster im Gehirn konnte gut zwischen akutem und chronischem CRPS unterscheiden. Es zeigt, dass chronisches CRPS ähnliche Veränderungen im Gehirn aufweist wie andere chronische Schmerzkrankheiten, insbesondere in Bereichen, die mit Motivation, Belohnung und Schmerzverarbeitung zusammenhängen.
Bei akutem CRPS waren hingegen Hirnnetzwerke stärker miteinander verbunden, die für die Selbstwahrnehmung und die Verarbeitung von Schmerz wichtig sind, etwa im Precuneus/posterioren Cingulum und in der vorderen Insula.
Das Universitätsklinikum Würzburg ist eines der führenden Zentren für CRPS-Forschung und leistet mit dieser Arbeit einen wichtigen Beitrag zum Verständnis der Hirnmechanismen bei CRPS. Aktuell läuft bereits eine zweite klinische Studie ResolveCRPS 2.0, um diese Erkenntnisse weiter zu vertiefen.
Publikation
Jiechu Chen, Mohammad Jammoul, Ann-Kristin Reinhold, Juliane Becker, Michael Harnik, Madalina Tivarus, György A. Homola, Magnus Schindehütte, Grit Hein, Claudia Sommer, Mirko Pham, Heike L. Rittner, Paul Geha. Resting-State Brain Activity in Acute and Chronic Complex Regional Pain Syndrome. Eur J Neurosci. 2025 Aug;62(3):e70220. doi: 10.1111/ejn.70220. PMID: 40799147.