Neben Maack sind eine Reihe weiterer Wissenschaftlerinnen und Wissenschaftler sowie Klinikerinnen und Kliniker aus der Universitätsmedizin Würzburg an der sogenannten COST Action (CA22169) beteiligt. Einen umfassenden Überblick über EU-METAHEART (EUropean network to tackle METAbolic alterations in HEART failure) liefert die Pressemeldung vom 30. Juni 2025.
In der Übersichtsarbeit „Mechano-energetic uncoupling in heart failure“ fassen Christoph Maack und Vasco Sequeira mit einem Team aus Würzburg, England, Österreich, Slowenien, Frankreich, Italien und den Niederlanden erstmals die enge Wechselwirkung zwischen Herzmechanik und mitochondrialer Energetik zusammen. Zudem entschlüsseln die Forscherinnen und Forscher, wie diese energetische Kopplung bei verschiedenen erworbenen und erblichen Formen der Herzinsuffizienz gestört ist.
Herzinsuffizienz entsteht durch ein Zusammenspiel verschiedener Störungen im Herzen, insbesondere in der Weiterleitung von elektrischen Signalen, der Energieversorgung und durch sogenannten oxidativen Stress, also einer Anhäufung von bestimmten Sauerstoffverbindungen, welche die Zellen schädigt. Diese Probleme sind eng miteinander verknüpft: Ist entweder die Kommunikation innerhalb der Herzmuskelzellen oder die Funktion der Mitochondrien gestört, kann sich ein Teufelskreis entwickeln, der zu einer dauerhaften Schädigung und Schwächung des Herzens führt.
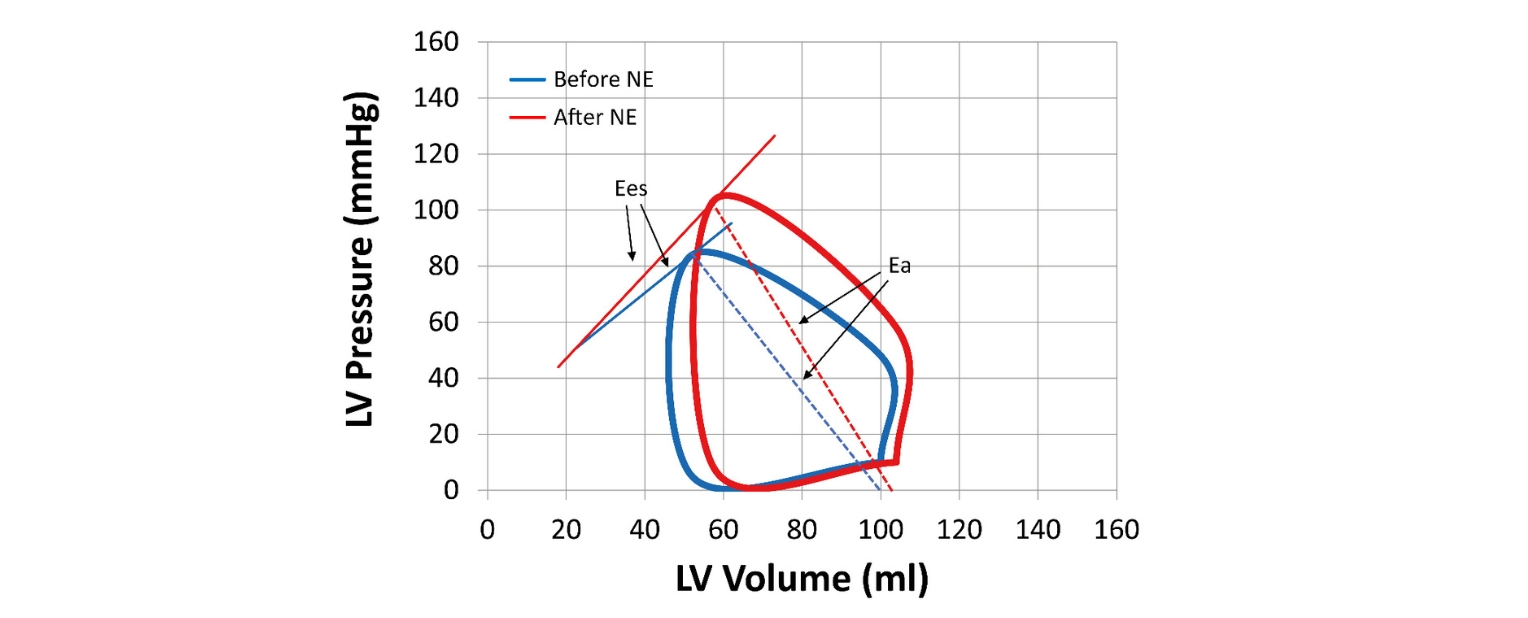
Im gesunden Herzen ist die Energiegewinnung über die Mitochondrien fein abgestimmt: Einerseits wird sie durch Kalzium (Ca²⁺) angestoßen, das die Energieproduktion anschiebt, („Push“). Andererseits wird sie durch den Energiebedarf in Form von Adenosindiphosphat (ADP) gezogen („Pull“).
Die Herzinsuffizienz mit reduzierter Pumpfunktion (HFrEF) wird in den meisten Fällen durch eine Herzschädigung ausgelöst. Diese führt zu einer Überaktivierung von Stresshormonen, welche die Signalweiterleitung im Herzen stören und den Kalziumhaushalt in den Mitochondrien aus dem Gleichgewicht bringen. Dies beeinträchtigt wiederum die Energieproduktion (gestörter „Push“).
Bei der Herzinsuffizienz mit erhaltener Pumpfunktion (HFpEF) wird das Herz dagegen in der Regel durch starkes Übergewicht, Bluthochdruck oder altersbedingten Veränderungen der Blutgefäße stark belastet, denn es muss gegen mehr Widerstand arbeiten. Die Energie, die das Herz dafür braucht, können die Mitochondrien jedoch nicht bereitstellen. Die Folge ist ein Energiemangel, der in oxidativen Stress umschlägt. Dieser kann schädliche Signalwege aktivieren, die das Herz übermäßig zusammenziehen lassen, das Zellwachstum fördern oder im schlimmsten Fall sogar zum Absterben der Zellen führen.
Auch bei erblich bedingten Herzkrankheiten kann es zu einer Entkopplung von Herzarbeit und Energieversorgung kommen. So führen beispielsweise bestimmte Gendefekte bei der hypertrophen Kardiomyopathie (HCM) dazu, dass das Herz übermäßig arbeiten muss (gestörter „Pull“). Beim seltenen Barth-Syndrom können die Mitochondrien dagegen kein Kalzium aufnehmen (gestörter „Push“).
Maack zufolge ist ein besseres Verständnis dieser komplexen Wechselwirkungen zwischen Herzarbeit und Energiehaushalt entscheidend, um bestehende Therapien gezielter einzusetzen und neue Behandlungen zu entwickeln. Ansätze, das Ungleichgewicht zu beheben wären eine Entlastung des Herzens, eine Verbesserung der Signalweiterleitung oder eine gezielte Unterstützung der Energieproduktion in den Mitochondrien. So könnte der Teufelskreis aus Energiemangel, Herzumbau und nachlassender Herzfunktion durchbrochen werden.
Dunja Aksentijevic, Simon Sedej, Jeremy Faucconier, Melanie Paillard, Mahmoud Abdellatif, Katrin Streckfuss-Bömeke, Renée Ventura-Clapier, Jolanda van der Velden, Rudolf A. de Boer, Edoardo Bertero, Jan Dudek, Vasco Sequeira & Christoph Maack. Mechano-energetic uncoupling in heart failure. Nat Rev Cardiol (2025). https://doi.org/10.1038/s41569-025-01167-6
Maack, C. Metabolic alterations in heart failure. Nat Rev Cardiol (2025). https://doi.org/10.1038/s41569-025-01181-8
Zur Pressemeldung zur Sonderbeilage und zu METAHEART