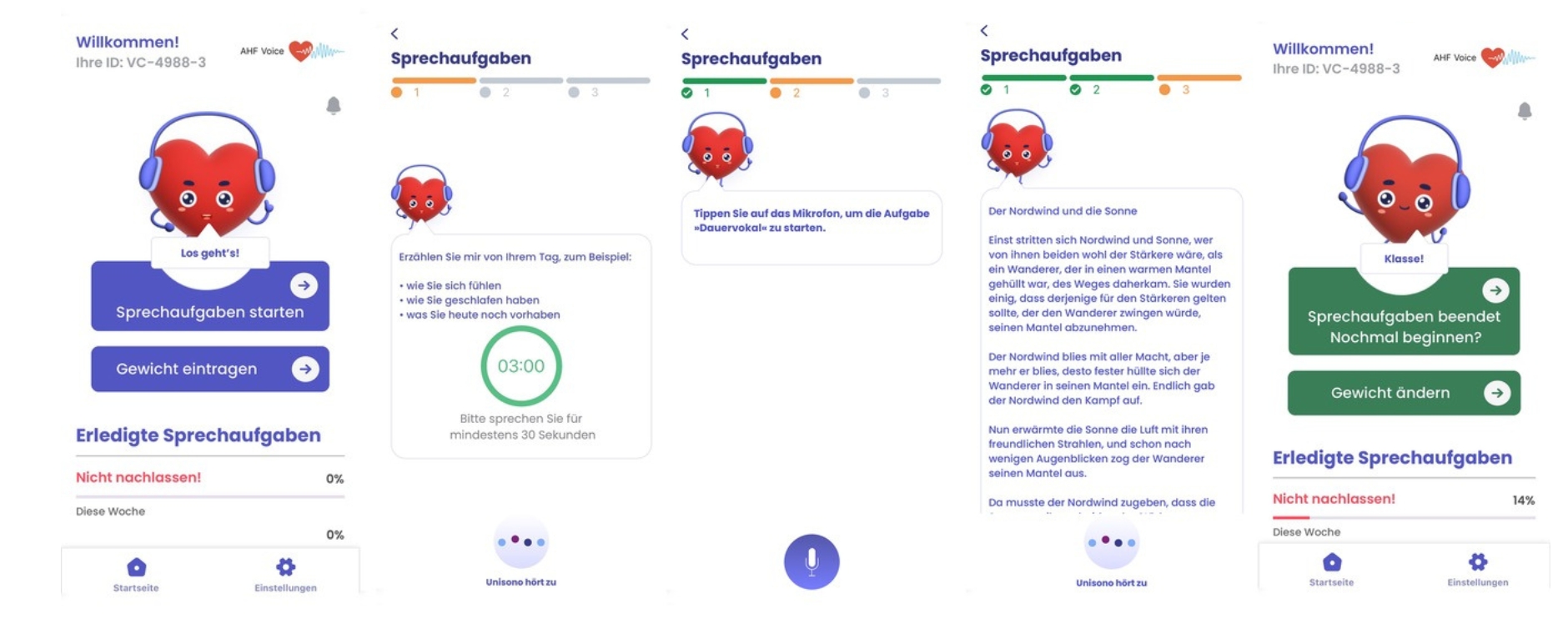
Die Stimme ist ein hochsensibler Spiegel unserer Gesundheit: Sie reagiert auf Flüssigkeitseinlagerungen, Nervenschäden, Lungenfunktion oder Erschöpfung. Schon kleinste Veränderungen in Klang, Tonhöhe oder Pausen beim Sprechen können Hinweise auf eine beginnende Verschlechterung geben – und das oft früher als klassische Symptome wie Atemnot. Der große Vorteil: Die Stimme lässt sich mit einem Smartphone einfach und regelmäßig messen – ideal für den Einsatz in der Telemedizin.
Stimme als Biomarker bei Herzinsuffizienz: Eine systematische Überprüfung
Die in Circulation: Heart Failure veröffentlichte Übersichtsarbeit zeigt, wie sich bestimmte Merkmale der Stimme bei Patientinnen und Patienten mit Herzschwäche messen lassen – und wie diese als sogenannte Stimmbiomarker helfen könnten, eine akute Krankheitsverschlechterung bei Herzschwäche (Herzinsuffizienz) frühzeitig zu erkennen. Herzinsuffizienz ist eine Volkskrankheit – sie betrifft weltweit über 64 Millionen Menschen und kann lebensbedrohlich werden, wenn sich Flüssigkeit im Körper staut. Genau hier setzt eine neue Idee an: Die menschliche Stimme verändert sich, wenn es dem Körper schlechter geht.
Der große Vorteil des Stimmbiomarkers ist, dass sich die Stimme ganz einfach über das Smartphone aufzeichnen und messen lässt – schnell, kontaktlos und ohne teure Geräte. Die Stimme könnte somit ein neuer Baustein in der digitalen Gesundheitsversorgung werden.
Maximilian Bauser, Fabian Kraus, Friedrich Koehler, Kristen Rak, Rüdiger Pryss, Christof Weiß, Andreas Hotho, Guy Fagherazzi, Stefan Frantz, Stefan Störk und Fabian Kerwagen. Voice Assessment and Vocal Biomarkers in Heart Failure: A Systematic Review. Circulation: Heart Failure. Apr 24, 2025. https://doi.org/10.1161/CIRCHEARTFAILURE.124.012303
Zur Publikation bei PubMed
Stimmliche Biomarker bei Herzinsuffizienz: Design, Grundprinzip und Ausgangsmerkmale der AHF-Voice-Studie
Obwohl die bisherigen Ergebnisse zu stimmlichen Biomarkern bei Herzinsuffizienz sehr vielversprechend sind, steht die Forschung erst am Anfang und viele Fragen sind noch offen. Hier setzt die innovative AHF-Voice-Studie am Universitätsklinikum Würzburg am: Über 130 Patientinnen und Patienten mit akuter Herzschwäche (AHF für Acute Heart Failure) wurden während ihres Krankenhausaufenthalts und bis zu sechs Monate danach begleitet – und zwar mit täglichen Sprachaufnahmen per App. So wird erforscht, ob und wie sich stimmliche Veränderungen als Frühwarnzeichen für eine Verschlechterung des Gesundheitszustands nutzen lassen.
Erstmals werden dabei auch Zusammenhänge zwischen Stimmbildung, Flüssigkeitseinlagerung, Lungenfunktion und der anatomischen Veränderung der Stimmlippen untersucht – zum Teil mit aufwändigen Videoaufnahmen des Kehlkopfs und phoniatrischen Spezialaufnahmen. Ziel ist es, die Stimme als zuverlässiges, alltagstaugliches Warnsignal für eine sich anbahnende Dekompensation zu etablieren – lange bevor Beschwerden auftreten. Das Studiendesign wurde im Journal Frontiers in Digital Health veröffentlicht.
Fabian Kerwagen, Maximilian Bauser, Magdalena Baur, Fabian Kraus, Caroline Morbach, Rüdiger Pryss, Kristen Rak, Stefan Frantz, Michael Weber, Julia Hoxha, Stefan Störk. Vocal Biomarkers in Heart Failure – Design, Rationale and Baseline Characteristics of the AHF-Voice Study. Frontiers in Digital Health, Mai 2025. Volume 7 - 2025, https://doi.org/10.3389/fdgth.2025.1548600
Zur Publikation bei PubMed