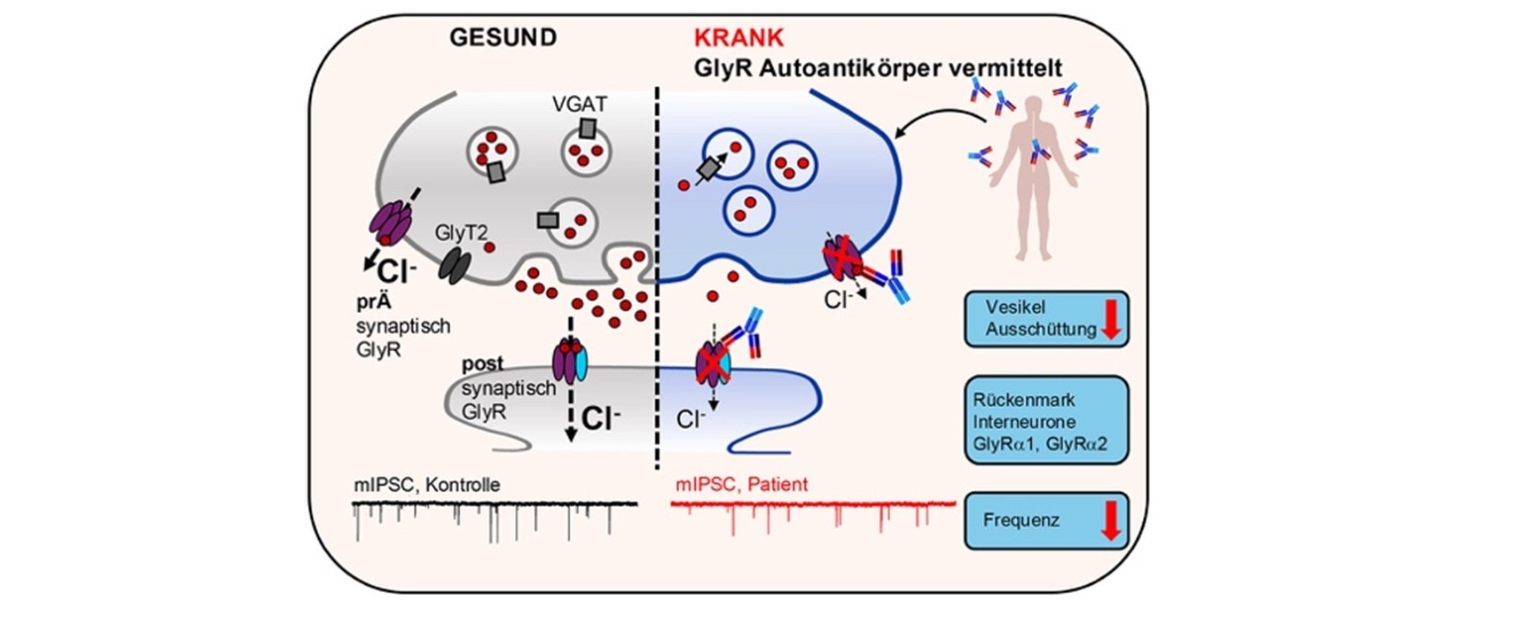
In einer kürzlich in Neurology - Neuroimmunology and Neuroinflammation erschienenen Publikation untersuchte Dr. Anna-Lena Wiessler vom Institut für Klinische Neurobiologie die Bindung, wie diese Autoantikörper auf bestimmte Schaltzellen im Nervensystem wirken. Dazu analysierte sie so genannte Glycinrezeptoren, die eine hemmende Wirkung auf die Erregung der Nervenzellen haben und sich an den Enden der Nervenzellen, also an den Synapsen befinden.
Mittels hochauflösender Mikroskopie und elektrophysiologischen Messungen zur Funktion des Rezeptors konnte sie zeigen, dass es als Folge der Bindung von Autoantikörpern an präsynaptische Glyzinrezeptoren zu einer Fehlfunktion der inhibitorischen Ionenkanäle kommt. Das heißt, dass die „Bremssignale“ im Nervensystem nicht mehr richtig funktionieren, was vermutlich zu den typischen Symptomen des Stiff Person Syndroms beiträgt. Damit wurde ein neuer Pathomechanismus der Autoantikörper gegen diese Ionenkanäle auf molekularer Ebene aufgeklärt.
Anna-Lena Wiessler, Fang Zheng, Christian Werner, Margarita Habib, Erdem Tuzun, Christian Alzheimer, Claudia Sommer, Carmen Villmann. Impaired presynaptic function contributes significantly tot he pathology of glycine receptor autoantibodies. Neurol Neuroimmunol Neuroinflamm. 2025 Mar;12(2):e200364. doi: 10.1212/NXI.0000000000200364