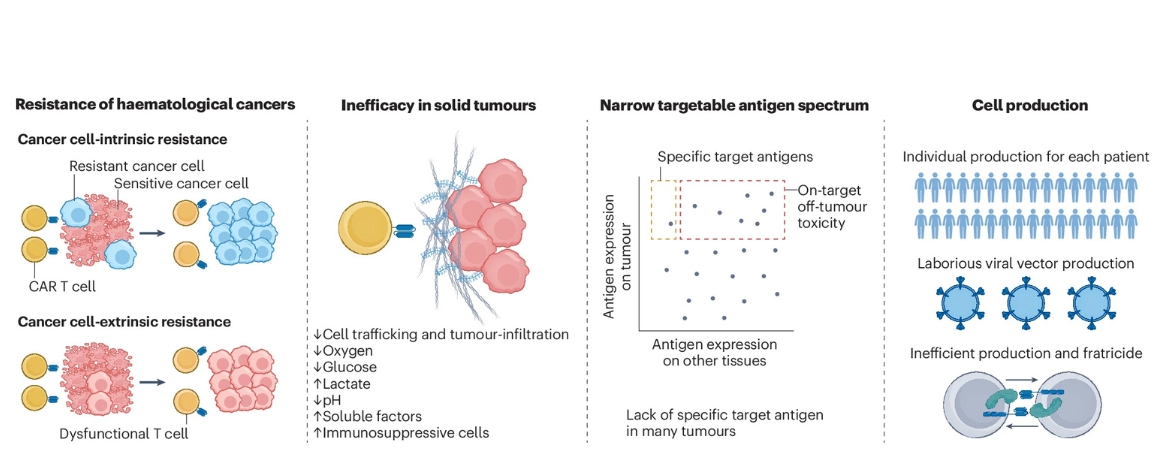
Es bestehen jedoch weiterhin Herausforderungen, darunter primäre und sekundäre Resistenzen, eine mangelnde Wirksamkeit bei soliden Tumoren, ein begrenztes Spektrum an ansteuerbaren Antigenen sowie zeitaufwändige und komplexe Herstellungsprozesse.
Die CRISPR-basierte Genomeditierung hat das Potenzial, die Wirksamkeit von T-Zellen gegen Tumoren zu verbessern. Base- und Prime-Editing, das sogenannte CRISPR 2.0, sind leistungsstärker und präziser als konventionelle CRISPR-Techniken. Statt Doppelstrangbrüche in der DNA zu erzeugen, ermöglichen Base- und Prime-Editing eine gezielte und effiziente Umschreibung von Gensequenzen.
In einem Review im Journal Nature Reviews Clinical Oncology beleuchten Forschende vom Uniklinikum Würzburg gemeinsam mit Kolleginnen und Kollegen anderer Forschungseinrichtungen die Herausforderungen als auch die vielversprechenden Chancen, die mit der Anwendung von CRISPR 2.0 in der T-Zell-Therapie einhergehen.
Sie diskutieren aufkommende CRISPR-2.0-Technologien und deren Fortschritte auf dem Weg zur klinischen Anwendung und beschreiben Strategien für den Einsatz von CRISPR 2.0 zur Weiterentwicklung zellulärer Immuntherapien für hämatologische Malignome und solide Tumoren in der Zukunft.
Karl Petri, Elvira D’Ippolito, Annette Künkele, Ulrike Köhl, Dirk H. Busch, Hermann Einsele & Michael Hudecek. Next-generation T cell immunotherapies engineered with CRISPR base and prime editing: challenges and opportunities. Nat Rev Clin Oncol (2025). https://doi.org/10.1038/s41571-025-01072-4