Würzburg. Seit September 2022 behandelt ein interdisziplinäres Team der Anämie-Ambulanz des UKW werdende Mütter mit Eisenmangel oder Eisenmangelanämie. Im Februar dieses Jahres wurde die tausendste Schwangere mit einer intravenösen Eiseninfusion therapiert. Das streng überwachte Behandlungskonzept der Klinik und Poliklinik für Anästhesiologie, Intensivmedizin, Notfallmedizin und Schmerztherapie ist in dieser Form deutschlandweit einzigartig. Entsprechend groß ist das Einzugsgebiet, das weit über Stadt und Landkreis Würzburg hinausreicht.
Dauermüde, abgeschlagen, schnell außer Puste: Solche Beschwerden werden in der Schwangerschaft oft als normale Begleiterscheinungen interpretiert. Hinter den zunächst harmlos erscheinenden Symptomen kann jedoch ein Eisenmangel oder eine durch Eisenmangel verursachte Blutarmut (Eisenmangelanämie) stecken. Unbehandelt kann dies gesundheitliche Risiken für Mutter und Kind bergen, darunter ein höheres Frühgeburtsrisiko, eine verlangsamte Entwicklung des ungeborenen Kindes und eine Wochenbettdepression.
Eisen ist essenziell für die Bildung roter Blutkörperchen und den Sauerstofftransport im Körper. Während der Schwangerschaft steigt der Eisenbedarf durch das wachsende Blutvolumen sowie die Versorgung der Plazenta und des ungeborenen Kindes deutlich an. Der Blutverlust rund um die Geburt belastet die Eisenspeicher der Frau zusätzlich.
„Ein Eisenmangel ist die häufigste Ursache einer Anämie in der Schwangerschaft. Er bleibt jedoch häufig unerkannt oder wird nicht ausreichend behandelt, obwohl eine effektive Therapie möglich ist“, erklärt Prof. Dr. Patrick Meybohm, Klinikdirektor der Anästhesie. Ein Bluttest, bei dem der Hämoglobinwert, der den roten Blutfarbstoff und damit die Sauerstofftransportfähigkeit abbildet, und der Eisenspeicherwert Ferritin gemessen werden, ermöglicht eine zuverlässige Diagnose. „Die Behandlung der tausendsten Patientin zeigt, wie relevant dieses Krankheitsbild ist.“
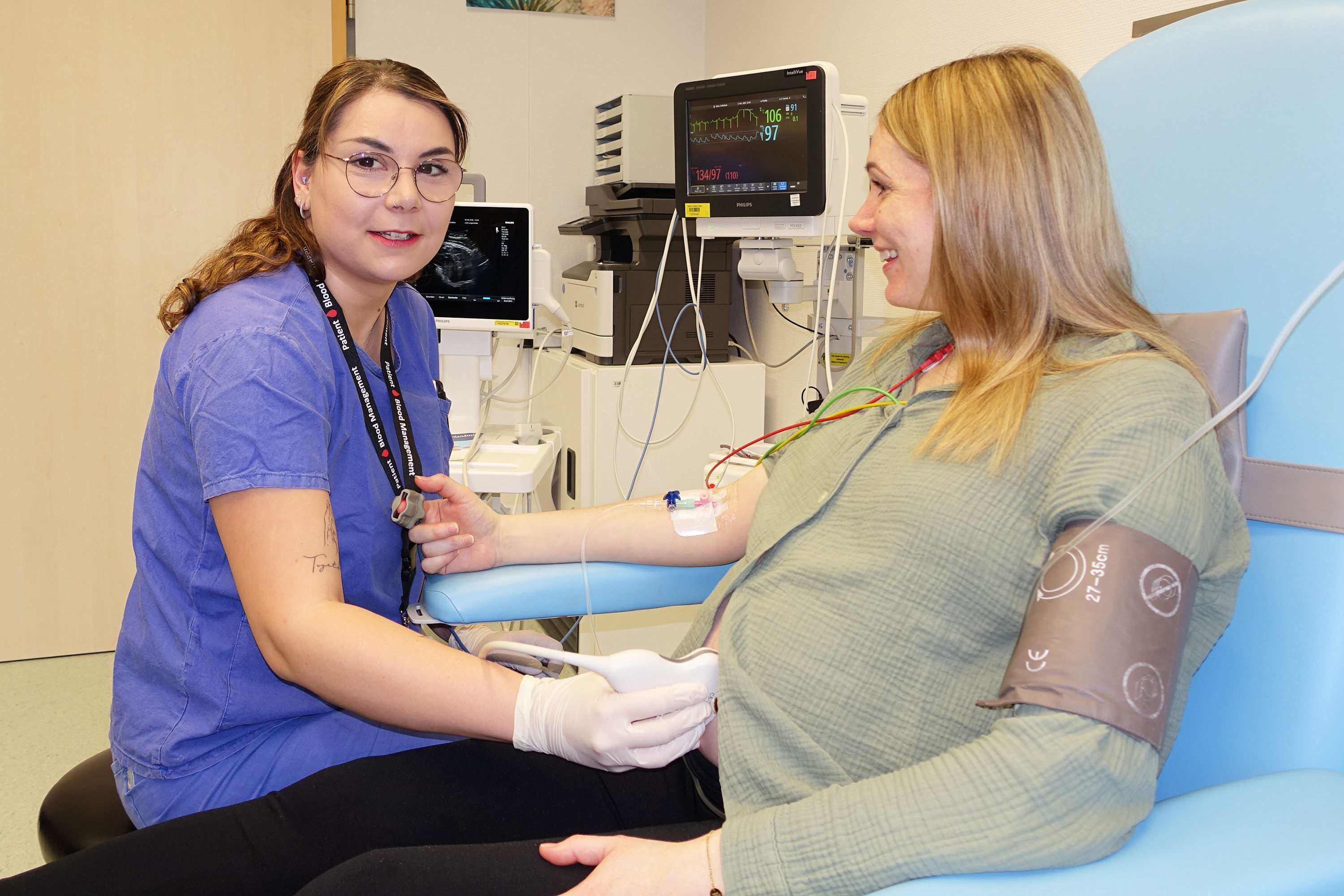
Antonia Krißmer ist die 1000. Patientin und froh über das Angebot, da sie während der Schwangerschaft unter einem schweren Eisenmangel litt. „Ich war extrem erschöpft und im Alltag kaum belastbar. Nach der Infusion habe ich mich deutlich stabiler gefühlt. Für mich war das eine große Entlastung in der Schwangerschaft“, erzählt die Jubiläumspatientin. Am 08. Februar 2026 kam ihr Sohn Levi gesund zur Welt.
Eisentabletten häufig nicht ausreichend wirksam
Ein diagnostizierter Eisenmangel wird oft zunächst mit Tabletten behandelt. „Orale Eisenpräparate können aber vor allem einen schweren Eisenmangel nicht zuverlässig ausgleichen. Zudem wirken sie langsam, es ist fraglich, wie viel Eisen aus ihnen aufgenommen wird, und sie verursachen vergleichsweise häufig Nebenwirkungen wie Verstopfung“, sagt Patrick Meybohm. Für den ersten Abschnitt der Schwangerschaft ist diese Therapieform jedoch nach wie vor die empfohlene. Vor allem, wenn frühzeitig eine Diagnostik erfolgt und der Therapieerfolg durch erneute Bluttests überprüft wird. Die intravenöse Eisengabe hingegen ermöglicht eine schnelle und gezielte Auffüllung der Eisenspeicher und verbessert das Symptombild rasch. Die Infusion wird individuell auf die Patientin abgestimmt und kann auch noch im dritten Trimenon einer Schwangerschaft, also in den letzten Tagen und Wochen vor der Geburt, verabreicht werden.
„Bei den meisten Patientinnen genügt eine einmalige Infusionsgabe, um die Eisenwerte zu stabilisieren. Je nach Befund und Schwangerschaftswoche kann kurz vor der Geburt eine erneute Gabe sinnvoll sein, um dafür optimale Voraussetzungen zu schaffen“, erläutert Prof. Dr. Peter Kranke, der die geburtshilfliche und gynäkologische Anästhesie am UKW leitet. Auch nach der Geburt erfolgt bei Bedarf eine Kontrolle der Eisenwerte. Insbesondere nach erhöhtem Blutverlust kann eine erneute Therapie sinnvoll sein, um eine Anämie nach der Geburt rasch zu beheben.
Dass diese Therapieform bislang nicht deutschlandweit etabliert ist, hat für Peter Kranke mehrere Gründe. „Ärztinnen und Ärzte sind bei der Behandlung von Schwangeren häufig zurückhaltend. Zudem verfügen vor allem die niedergelassenen Kolleginnen und Kollegen oft nicht über die notwendigen räumlichen, zeitlichen und personellen Ressourcen für eine eng überwachte Infusionstherapie. Deshalb wird die für sie weniger aufwändige Behandlung mit Tabletten bevorzugt.“ Prof. Dr. Ulrich Pecks, der die Geburtshilfe und den Bereich Fetomaternale Medizin am UKW leitet, betont aber: „Das Interesse der Behandlerinnen und Behandler am Würzburger Behandlungskonzept wächst stetig.“ Regelmäßig hospitieren Interessierte aus ganz Deutschland in der Anämie-Ambulanz, um von den dort gemachten Erfahrungen zu profitieren.
Permanente Überwachung sorgt für hohe Sicherheit
Die Gabe von Eisenpräparaten kann, unabhängig von der Darreichungsform, in sehr seltenen Fällen Nebenwirkungen verursachen. Dazu zählen Blutdruckabfall und in den seltensten Fällen eine allergische Reaktion. „Schwere Komplikationen haben wir bislang nicht beobachtet. Dennoch sorgt die permanente Überwachung der Vitalzeichen für maximale Sicherheit während der Infusionsgabe“, erklärt Karina Reinhard, Leitende Anämie Nurse in der Ambulanz.
Zusätzlich erfolgt vor und nach der Infusion eine Ultraschallkontrolle, um das Wohlbefinden des Kindes zu überprüfen.
Kontakt und Terminvergabe
Schwangere können über ihre hausärztliche oder gynäkologische Praxis, die behandelnde Klinik oder das Geburtshaus in die Anämie-Ambulanz in der Anmeldung 11 im Zentrum für Operative Medizin des UKW überwiesen werden. Sie können auch selbst Kontakt aufnehmen und einen Termin über das Onlineportal der Ambulanz vereinbaren. In der Regel ist eine Vorstellung innerhalb von ein bis zwei Wochen möglich. Die Behandlung ist eine Kassenleistung und für Schwangere kostenfrei.
Eisenmangel gezielt behandeln und vorbeugen – nicht nur in der Schwangerschaft
In der Anämie-Ambulanz des UKW werden nicht nur Schwangere, sondern auch Menschen behandelt, die vor größeren Operationen stehen. Eine mit hohem Blutverlust verbundene Operation kann die Eisenspeicher rasch erschöpfen. Durch eine gezielte Prävention vor dem Eingriff können postoperative Mangelzustände vermieden, das Risiko für Bluttransfusionen gesenkt und die Genesung nach der Operation unterstützt werden. Darüber hinaus werden Patientinnen und Patienten mit bestehendem Eisenmangel unabhängig von Schwangerschaft oder Operation behandelt, etwa infolge chronischer Erkrankungen, Entzündungen, Verletzungen oder bestimmter Ernährungsweisen.
All dies ist in das Patient Blood Management der Klinik und Poliklinik für Anästhesiologie, Intensivmedizin, Notfallmedizin und Schmerztherapie eingebettet. Das evidenzbasierte, medizinische Konzept hat das Ziel, die Patientensicherheit zu erhöhen, indem die körpereigenen Blutreserven von Patientinnen und Patienten frühzeitig optimiert, Anämien rechtzeitig erkannt und das Risiko für Bluttransfusionen reduziert wird.
Entsprechend richtet sich das Angebot der Anämie-Ambulanz des UKW ausdrücklich auch an nicht schwangere Patientinnen und Patienten mit diagnostiziertem oder zu erwartendem Eisenmangel.
Text: Annika Wolf / UKW