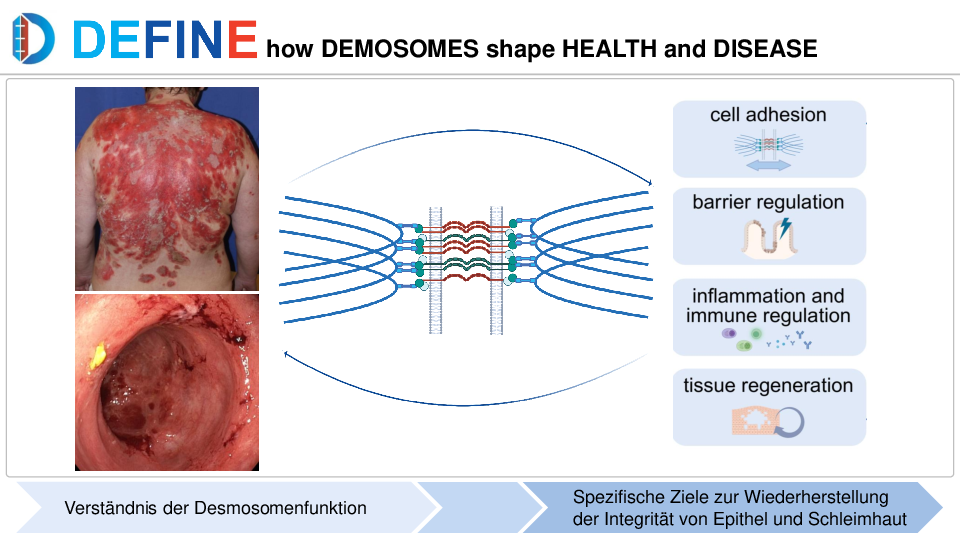


Würzburg. Leuchttürme dienen der Orientierung und Sicherheit, sie haben Strahlkraft und stehen für Zuversicht. All dies trifft auch auf die Leuchtturmprojekte des Bayerischen Zentrums für Krebsforschung (BZKF) zu. Sie setzen sichtbare Impulse und weisen der innovativen Krebsforschung in Bayern den Weg nach vorn. An jedem der sechs BZKF-Standorte gibt es einen solchen Leuchtturm, der sich auf die spezifischen Stärken des jeweiligen Standorts fokussiert. Dadurch wird vorhandene Expertise genutzt, gebündelt und gezielt ausgebaut.
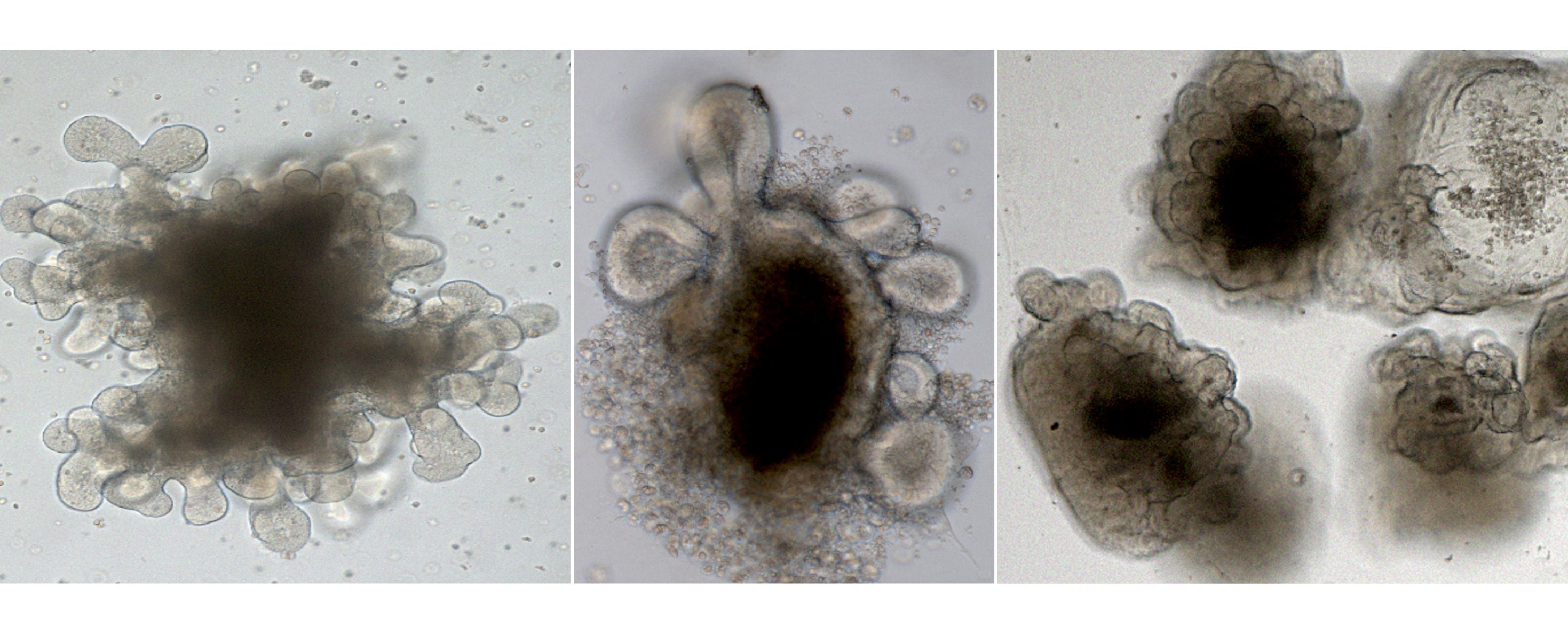
Datenbanken umfassen inzwischen rund 150 humane Organoid-Modelle verschiedener Tumorentitäten sowie knapp 40 Tierversuchsmodelle
Am Uniklinikum Würzburg (UKW), in der Klinik und Poliklinik für Allgemein-, Viszeral-, Transplantations-, Gefäß- und Kinderchirurgie (Chirurgie I), liegt die Expertise unter anderem auf der Organoid-Technologie. Mithilfe von Organoiden können Krankheitsmechanismen verstanden und neuartige Therapieansätze getestet werden.
Daher wurde vor zwei Jahren hier der BZKF-Leuchtturm „Präklinische Modelle“ unter der Planung von Prof. Dr. Armin Wiegering aufgestellt. Nach dessen Wechsel nach Frankfurt am Main übernahm Prof. Dr. Nicolas Schlegel, Inhaber des Lehrstuhls für Experimentelle Viszeralchirurgie am UKW, die Sprecherfunktion. Gemeinsam mit seinem Team bestehend aus Prof. Dr. Christoph Otto, Anne Rech, Dr. Mahasen Saati sowie Prof. Dr. Gabriele Büchel von der Universität Würzburg, konnte er in der ersten Förderperiode zwei standortübergreifende Datenbanken aufbauen: die Organoid-Datenbank mit inzwischen rund 150 Ex-Vivo-Modellen verschiedener Tumorentitäten sowie die Datenbank für In-Vivo-Modelle mit derzeit knapp 40 onkologischen Tierversuchsmodellen.
BZKF bewilligt 980.000 Euro für die zweite Förderperiode
Der intensive Arbeitsaufwand in dieser kurzen Zeit hat das BZKF überzeugt. Die zweite Förderphase wurde bewilligt. „Ein enormer Erfolg!“, freut sich Nicolas Schlegel. Mit der maximal möglichen Fördersumme von insgesamt 980.000 Euro will das Team in den nächsten zwei Jahren die Verfügbarkeit präklinischer Modelle an allen sechs BZKF-Standorten sichtbarer machen. Hierzu sollen die Datenbanken optimiert und auf einer Plattform zusammengeführt werden. Ein weiteres wichtiges Ziel ist es, die Einheit zur Validierung vielversprechender therapeutischer Zielstrukturen so weiter auszubauen, dass eine schnellere Übersetzung von Grundlagenforschung in die klinische Anwendung erreicht wird.
Doppelstrukturen vermeiden und Synergieeffekte schaffen
„Präklinische Modelle sind für die medizinische Forschung unverzichtbar – sowohl für den Weg aus der Grundlagenforschung in die Klinik als auch zurück, also Translation Forward und Reverse“, sagt Nicolas Schlegel. Doch es ist sehr aufwändig, solche Modelle zu entwickeln. Damit nicht jede Gruppe alles immer wieder neu etablieren muss, informieren Datenbanken darüber, welche Modelle wo vorgehalten werden und wer für die Durchführung der Experimente kontaktiert werden kann. Dadurch sollen Doppelstrukturen vermieden und Synergieeffekte geschaffen werden. Ein wichtiges Ziel hierbei ist, die Zahl der Tierversuche im Sinne des 3R-Prinzips zu reduzieren (reduce), zu ersetzen (replace) und zu verbessern (refine). Dies kann nur durch eine optimale Planung erreicht werden.
Datenbanken miteinander verknüpfen, um die gesamte Translation abzubilden
„Nachdem wir die beiden Datenbanken auf der webbasierten Plattform REDCap aufgebaut und für jede Tumorentität eine eigene Eingabemaske entwickelt haben, wollen wir im nächsten Schritt die Dateneingabe und Abfrage noch intuitiver gestalten und alle Modelle zusammenführen. Damit soll die gesamte Translation auf einer Plattform in logischem Zusammenhang abgebildet werden“, berichtet Nicolas Schlegel und nennt zwei Beispiele. „Wir haben ein Organoid aus Gewebespenden eines Patienten, das bestimmte Mutationen aufweist. Über die Datenbank könnten wir ein passendes Tiermodell mit der humanen Veränderung assoziieren. Aus diesem Tiermodell könnten wir auch murine Organoid-Modelle entwickeln. Dieses passt zum humanen Modell und reduziert Tierversuche. Ähnlich verfahren wir, wenn wir in Zellkulturexperimenten eine interessante Zielstruktur entdecken: Zunächst wird diese in einem Organoid auf ihre Wirksamkeit getestet und im nächsten Schritt gegebenenfalls im Tiermodell angewandt, bevor sie für die Anwendung am Menschen weiterentwickelt werden kann. Diese komplexen Schritte zu vereinfachen, ist das Ziel der Datenbank."
Abbau von bürokratischen Hürden in der Versuchsplanung
Leider kann noch nicht gänzlich auf Tierversuche verzichtet werden, vor allem, wenn es darum geht, die Komplexität eines gesamten Organismus im Zusammenhang zwischen immunologischen Prozessen und Tumorentstehung abzubilden. Doch trotz des hohen Niveaus der Versuche sind die bürokratischen Hürden, neue Dinge weiterzuentwickeln, häufig noch höher. Das erschwert den internationalen Wettbewerb, gefährdet Karrieren und treibt junge Talente aus der akademischen Forschung in die Industrie, gibt Nicolas Schlegel zu bedenken. „Ein Ziel ist deshalb, die Genehmigungsprozesse zu verbessern, indem wir Protokolle detailliert abbilden, Anträge standardisieren und Tierversuchsvorhaben harmonisieren“, erklärt er und verweist auf andere Bundesländer, in denen die Standardisierung gut gelinge.
Vereinfachung der Target-Validierung
Einen weiteren wichtigen Schwerpunkt im Leuchtturmprojekt verfolgt Prof. Dr. Gabriele Büchel vom Lehrstuhl für Biochemie und Molekularbiologie. Die Professorin für Dynamik zellulärer Proteinkomplexe versucht, bisher unzugängliche Zielstrukturen in Tumorzellen mit einer neuen Klasse von Arzneistoffen zu adressieren. Diese können krankmachende Proteine im Körper gezielt abbauen.
In der Onkologie versucht man normalerweise, diese krankheitsauslösenden Proteine zu hemmen, beispielsweise indem ihre enzymatische Aktivität blockiert wird. Im neuen Ansatz werden die Proteine jedoch komplett aus der Zelle entfernt, indem man ihren Abbau einleitet. Dies erfolgt mithilfe des zellulären Mülleimersystems, dem Proteasom. Damit die Proteine gezielt zum Proteasom gelangen, werden sie mit sogenannten PROTACs (Proteolysis Targeting Chimeras) markiert. Allerdings müssen die PROTACs für jedes Zielprotein individuell hergestellt werden, was sehr aufwendig und zeitintensiv ist. Deshalb entwickelt Gabriele Büchel derzeit ein Modellsystem, mit dem geprüft werden kann, ob ein Protein tatsächlich therapeutisch vielversprechend ist und es sich lohnt, im nächsten Schritt ein teures PROTAC zu entwickeln. „Mithilfe dieses vereinfachten und effizienten Forschungsmodells können neue Therapie-Zielstrukturen getestet werden, ohne dass sofort komplexe Wirkstoffe hergestellt werden müssen“, fasst Nicolas Schlegel zusammen.
Je mehr sich registrieren, desto besser wird das Netzwerk und letztlich die Forschung
„Je mehr Wissenschaftlerinnen und Wissenschaftler sich registrieren und ihre Modelle verfügbar machen, desto besser wird natürlich das Netzwerk und letztlich auch die Forschung im gesamten BZKF“, sagt Schlegel und nimmt Skeptikerinnen und Skeptikern gleich eine Sorge: „Es gibt Transfer-Agreement-Sheets, in denen vertraglich geregelt wird, was genau mit dem Organoid gemacht werden darf.“ Die Datenbank soll andererseits auch bei der Recherche helfen. Schlegels Wunsch ist es, dass Personen innerhalb und außerhalb des BZKF-Netzwerks, die zu einer Tumorentität Fragestellungen beantworten möchten, zuerst die Datenbank nutzen, um sich einen Überblick über die Verfügbarkeit humaner Organoid- und Tiermodelle zu verschaffen. Dadurch würde erheblich Zeit und Geld gespart, da nicht alles immer selbst entwickelt werden müsste.
Ein Kontaktformular für die Registrierung gibt es auf der Webseite des Lehrstuhls für Experimentelle Viszeralchirurgie.
Über die Leuchtturmstrukturen des BZKF
Die Leuchtturmstrukturen sind die Grundlage für komplexe Weiterentwicklungen in den jeweiligen Bereichen. Sie übernehmen Servicefunktionen für das gesamte BZKF. Durch den Austausch von Proben und die Zuweisung von Patientinnen und Patienten mit besonderen Fragestellungen an die jeweils hochspezialisierte Stelle wird eine optimale Diagnostik und Therapie ermöglicht und es werden schnellere Fortschritte in den jeweiligen Bereichen erzielt. Diese Fortschritte kommen wiederum allen zugute. Die Leuchtturmstrukturen und die standortübergreifende Nutzung ihrer Expertise sichern die internationale Exzellenz und die bayernweite Teilhabe sowie die Verbesserung der Versorgung der Patientinnen und Patienten im BZKF. Weitere Informationen finden Sie unter: bzkf.de/standortspezifische-leuchttuerme
Text: Kirstin Linkamp / Wissenschaftskommunikation UKW