Zentrale Evolutionsmechanismen beim Multiplen Myelom hatte Privatdozent Dr. Leo Rasche vom Uniklinikum Würzburg schon im vergangenen Jahr mit einem internationalen Autorenteam entschlüsselt und im Fachjournal Nature Communications publiziert. So kann eine einzige Tumorzelle, die die Chemotherapie überlebt hat und Jahre lang im Knochenmark schlummert, zum Rückfall führen. Auch nach einer modernen Immuntherapie, welche die Behandlung des Multiplen Myeloms geradezu revolutioniert hat, müssen die Patientinnen und Patienten mit einem Rezidiv rechnen. „Mit bispezifischen Antikörpern oder Gen-manipulierten T-Zellen, den sogenannten CAR-T-Zellen, können wir zwar selbst bei weit fortgeschrittenen Krankheitsstadien langanhaltende Remissionen erzielen, die Patientinnen und Patienten aber nicht dauerhaft heilen“, erläutert Leo Rasche. In einer neuen Publikation im Journal Nature Medicine hat der Hämatoonkologe jetzt mit einem internationalen Team aus Deutschland, Kanada und den USA dargelegt, warum die Immuntherapien ihre Wirkung verlieren.
Zwei wesentliche Resistenzmechanismen – BCMA und GPRC5D
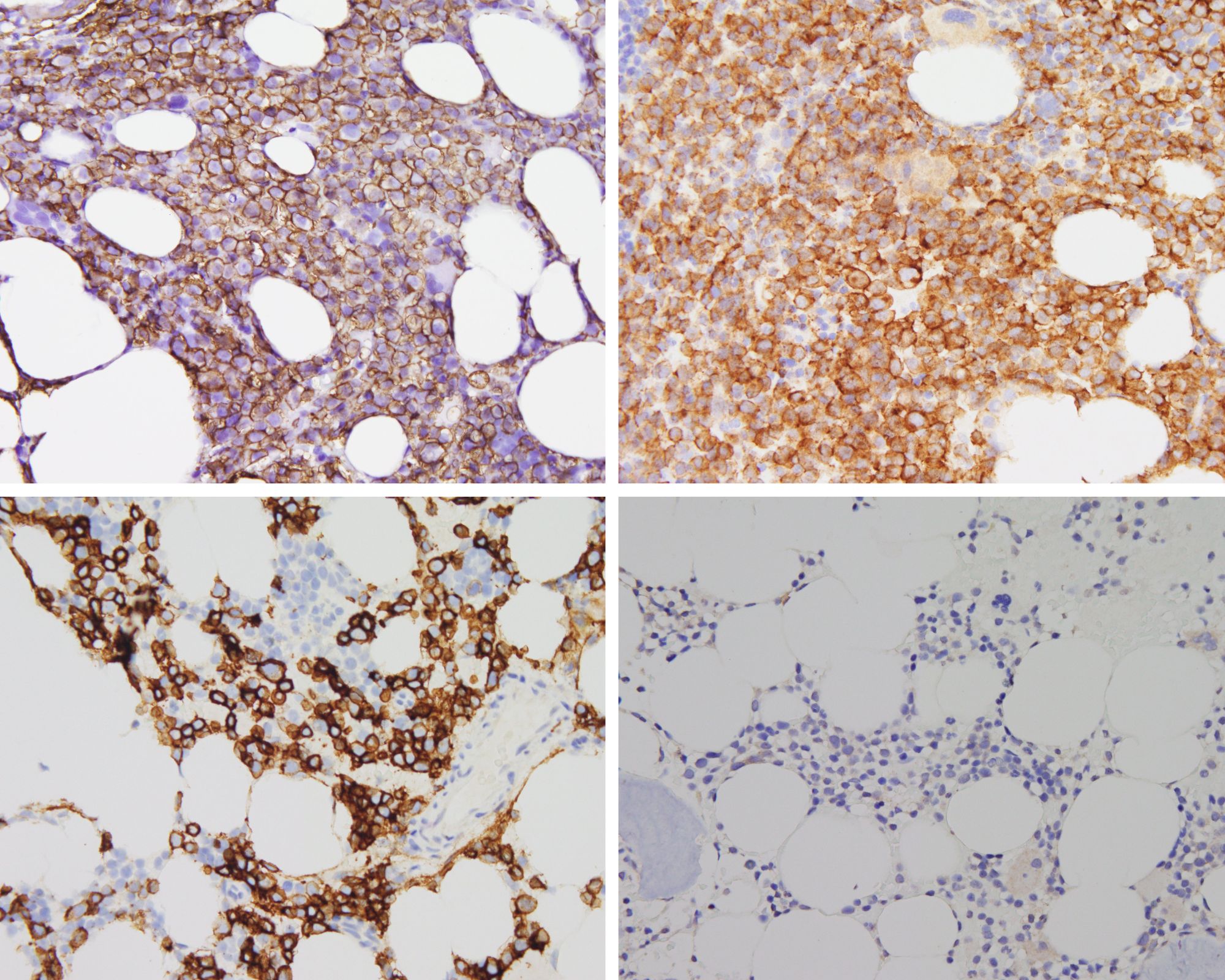
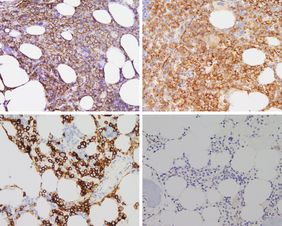
Die Forschenden hatten konkret zwei Antigene im Visier, die sich auf der Oberfläche von Myelomzellen befinden und entscheidende Zielstrukturen für Immuntherapien sind: das B-cel maturation Antigen, kurz BCMA und das Transmembranprotein GPRC5D (G Protein-Coupled Receptor Class C Group 5 Member D). Dass BCMA eine Schlüsselrolle bei der Resistenz spielt, hatte Leo Rasche bereits vor zwei Jahren im Nature Medicine veröffentlicht. Ein intensiv vorbehandelter Myelom-Patient mit schlechter Prognose sprach spektakulär auf die CAR-T-Zell-Therapie an, das Knochenmark schien von Tumorzellen befreit zu sein. Doch nach fünf Monaten war es erneut mit Myelom-Zellen geflutet, der Patient starb. „Überraschenderweise war unser Ziel-Antigen, das BCMA, verloren gegangen“, sagt Leo Rasche. Auf den Krebszellen, die während des Rückfalls neu entstanden sind, fehlte plötzlich der Genabschnitt, der den Code für das BCMA enthält. „Unsere Vermutung, dass es schon vor der Behandlung mit CAR-T-Zellen vereinzelt gentechnische Varianten der Tumorzellen ohne BCMA gab, konnten wir nun bestätigen. Eine Punktmutation im Gen, welches für das Tumorantigen BCMA kodiert, reicht aus, dass einige bispezifische Antikörper, wenn auch nicht alle, die Tumorzellen nicht mehr erkennen können.“ Ferner konnte das Team aus Würzburg zeigen, dass eine Therapie gegen GPRC5D mit dem bispezifischen Antikörper Talquetamab zu einer Selektion von Tumor-Subklonen führt, die das Tumorantigen GPRC5D nicht mehr tragen.
Parallelevolutionen von Tumorzellen vergleichbar mit der Evolution der Rüsseltiere
„Interessanterweise zeigten sich eine Vielzahl unterschiedlicher Klone, die alle auf ihre eigene Weise einen genetischen Mechanismus aufwiesen, der zum GPRC5D Verlust geführt hat“, betont Leo Rasche. „Das heißt wir haben bei unseren Patientinnen und Patienten in Würzburg Parallelevolutionen entdeckt, so wie man es häufig in der Entwicklung der Lebewesen auf unserem Planeten beobachten kann.“ Der Oberarzt in der Medizinischen Klinik und Poliklinik II am UKW vergleicht die Parallelevolution mit der Evolution der Rüsseltiere mit den verschiedenen Entwicklungen von Mastodonten, Mammuts und Elefanten. Wenn die einen aussterben, nutzen die anderen den Überlebensvorteil und breiten sich aus.
Immuntherapien auf mehrere Antigene richten
„Unsere Arbeit wird dazu führen, dass man gezielt nach den von uns entdeckten Mutationen in der Routineversorgung von Patienten mit Multiplem Myelom suchen wird, um passgenau alternative Immuntherapien auszuwählen“, ist sich Rasche sicher. Um den Selektionsdruck zu vermeiden könne man nicht nur gegen ein spezifisches Antigen feuern, sondern gleich zwei oder drei Ziele gleichzeitig adressieren. Die neuen Immuntherapien werden bereits sequenziell, also nacheinander angewendet. Wie sich die klonale Architektur dadurch verändert und ob eventuell zu einem späteren Zeitpunkt wieder antigenpositive Varianten auftauchen, sei Rasche zufolge aktuell ungeklärt und bliebe ein spannendes und relevantes Forschungsgebiet.
Prof. Dr. Herrmann Einsele, Direktor der Medizinischen Klinik und Poliklinik II des Uniklinikums Würzburg resümiert: „Diese Beobachtungen werden einen erheblichen Einfluss auf die weitere Entwicklung der CAR-T-Zell-Therapie beim Multiplen Myelom haben und die in Würzburg verfolgten Strategien, neue Zielstrukturen auf Tumorzellen zu identifizieren und Multitarget-CAR-T-Zellen zu entwickeln noch aussichtsreicher machen.“
Publikation:
Lee, H., Ahn, S., Maity, R. et al. Mechanisms of antigen escape from BCMA- or GPRC5D-targeted immunotherapies in multiple myeloma. Nat Med (2023). https://doi.org/10.1038/s41591-023-02491-5
Ansprechpartner:
Nizar Bahlis und Paola Neri aus Calgary, Kanada
Francesco Maura, Miami, USA
Claudia Haferlach, München
Stefan Knop, Nürnberg
Leo Rasche, Würzburg: Rasche_L(at)ukw.de
Weitere Informationen zu Immuntherapien beim Multiplen Myelom
Jedes Jahr erhalten allein in Deutschland rund 7.000 Menschen die Diagnose Multiples Myelom. Dauerhaft geheilt werden kann diese Krebserkrankung, die von veränderten Plasmazellen im Knochenmark ausgeht, noch nicht. Denn auch nach vermeintlich erfolgreicher Therapie müssen die Betroffenen immer mit einem Rezidiv rechnen. Mit einem besseren Verständnis der Evolution dieser entarteten Knochenmarkzellen könnten aber die Diagnose und Behandlung optimiert werden.
Als große Hoffnungsträger gelten Immuntherapien mit Antikörpern oder Gen-manipulierten T-Zellen, den so genannten CAR-T-Zellen. Die Wahl der Immuntherapie und ihr Erfolg hängt im entscheidenden Maße davon ab, ob, wie viele und welche Antigene sich auf der Krebszelle befinden.
Eine der vielversprechendsten Behandlungsmethoden gegen den Knochenmarkkrebs sind CAR-modifizierte Immunzellen. Bei der zellulären Immuntherapie wird den weißen Blutkörperchen unseres Immunsystems, den T-Zellen, auf die Sprünge geholfen. Dazu werden die T-Zellen gentechnologisch verändert und im Labor mit einem künstlichen auf die entsprechende Krebsart zugeschnittenen Rezeptor ausgestattet, dem Chimären Antigen Rezeptor, kurz CAR. Anschließend werden die „scharf gestellten“ T-Zellen als lebendes Medikament dem Patienten zurückgegeben. Mithilfe des spezifischen Oberflächenmarkers können die CAR-T-Zellen die Tumorzellen im Körper aufspüren und zerstören.
Bei einer Antikörpertherapie werden den Betroffenen künstliche Proteine infundiert, die mit den körpereigenen Immunzellen reagieren, indem sie an ihr entsprechendes Antigen binden, und so letztlich zu einem besseren Anti-Tumor-Effekt führen. Bispezifische Antikörper können zeitgleich an zwei verschiedene Oberflächenmerkmale binden, mit dem einen Arm an das der Immunzelle, mit dem andern an das der Tumorzelle. Dadurch werden die Immunzellen sozusagen zur Tumorzelle geführt, die es zu vernichten gilt.
Das Universitätsklinikum Würzburg (UKW) spielt bei der Erforschung, Anwendung und Ausweitung dieses neuen Arzneimittelprinzips eine international bedeutende Rolle. So wird in Würzburg das größte Myelom-Programm in Europa mit vielem klinischen Studien und Begleitforschung zu den neuesten Therapieformen wie CAR T Zellen und verschiedenen T Zell aktivierenden (bispezifischen) Antikörpern angeboten. Prof. Dr. Hermann Einsele, Direktor der Medizinischen Klinik und Poliklinik II des UKW und Sprecher des neu gegründeten Nationalen Centrum für Tumorerkrankungen (NCT) WERA, gilt als Meinungsführer in der CAR-T-Zelltherapie, er hat diese als erster in Europa klinisch eingesetzt und eine internationale Studie mitkonzipiert und entwickelt, die im Juli 2023 erstmals in randomisierter Form eine Überlegenheit der CAR-T-Zelltherapie gegenüber einer konventionellen Behandlung beim fortgeschrittenen Multiplen Myelom (in der 2. und 4. Therapielinie) gezeigt hat.